Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Ein pH-Indikator ist ein Farbstoff, der auf saure oder basische Lösungen mit einer Farbänderung reagiert. Ein bekanntes Beispiel aus dem Haushalt ist Blaukraut bzw. Blaukrautsaft. Dieser wechselt in Anwesenheit von Säuren seine Farbe nach Rot, erscheint im Neutralen Blau und in Anwesenheit von Laugen verfärbt er sich Grün bis Gelb. Somit erklärt sich auch der Unterschied zwischen Rotkraut und Blaukraut - es handelt sich hierbei um die selbe Pflanze, jedoch führt der pH-Wert des Bodens auf welchem sie wächst zu einer unterschiedlichen Farbe.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Blaukraut, Magnetrührer, Rührfisch, 400ml Becherglas, 5x 250ml Becherglas, Messer
Chemikalien
30% Salzsäure
Zitronensäure
Natriumhydrogencarbonat
Natriumhydroxid
Durchführung
Ein Teil des Blaukrauts wird in kleine Stücke geschnitten, in das Becherglas gegeben und auf dem Magnetrührer mit dest. Wasser ausgekocht, bis im Wasser eine violette Färbung auftritt.
Nach dem Dekantieren kann der Extrakt nun dazu verwendet werden, pH-Werte von anderen Flüssigkeiten zu untersuchen.
Dazu werden in die 5x 250ml Bechergläser jeweils die gleiche Menge an Extrakt eingefüllt. Dann werden nacheinander verdünnte Lösungen von Salzsäure, Zitronensäure, Natron sowie Natriumhydroxid hinzugegeben.
Entsorgung
Im Abguss.
Erklärung
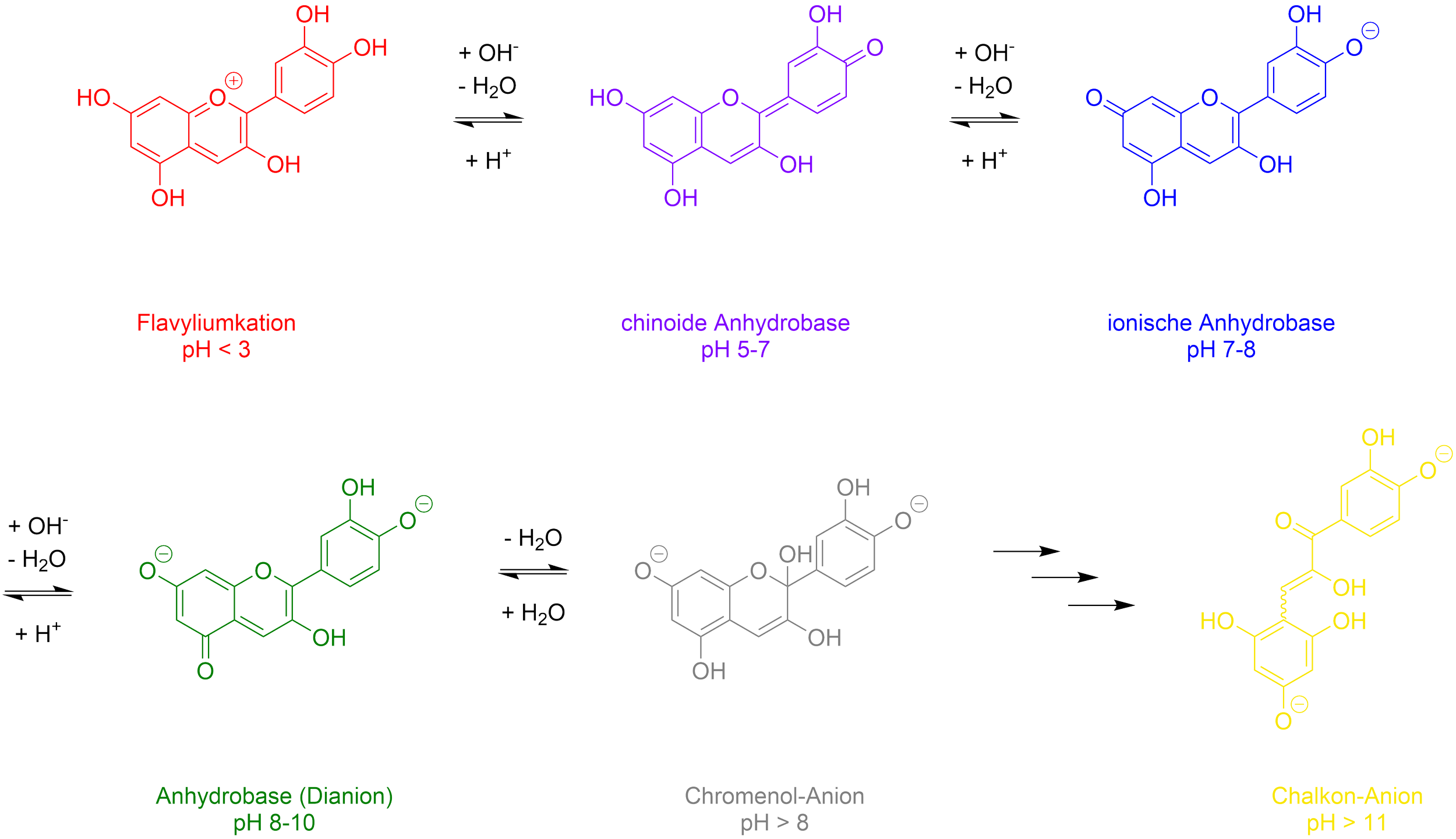
Bei pH-Werten < 3 liegt das im Blaukraut vorkommende Anthocyan Cyanidin als rotes Flavyliumkation vor. Zwischen pH-Werten von 5 und 7 liegt der Farbstoff als chinoide Anhydrobase vor und erscheint violett. Im leicht alkalischen Mileu kommt es zu einer Delokalisierung der π-Elektronen über die drei Sechsringe und die Sauerstoffatome der Phenolat-Gruppe, was zu einer blauen Färbung führt. Bei pH-Werten ab 8 liegt Cyanidin als grünes Dianion vor, welches mit einem farblosen Chromenol-Anion konkurriert. Im stark alkalischen Mileu kommt es zur hydrolytischen Öffnung des Pyranringes und das Molekül wird zu einem gelben Chalkon-Anion umgewandelt.