Kristallwasser in Kupfersulfat
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Reagenzglas, Stativ + Klemme, Bunsenbrenner, Feuerzeug
Chemikalien
Kupfersulfat
Durchführung
Das Reagenzglas wird mit einer kleinen Menge Kupfersulfat befüllt und am Stativ in der Brennerflamme vorsichtig erhitzt. Es bilden sich Kondensat-Tropfen die nach der Zeit vollständig verdampfen, während das Kupfersulfat seine blaue Farbe verliert. Gibt man nun wieder Wasser hinzu verfärbt sich das Kupfersulfat wieder nach blau.
Entsorgung
Kupfersulfat wird im Behälter für anorganische Schwermetallabfälle gesammelt.
Erklärung
Die fünf Wassermoleküle sind im Kupfersulfat-Gitter unterschiedlich gebunden. Vier davon sind quadratisch-planar an Cu 2+ koordiniert und lassen sich bis 100°C abspalten. Das fünfte Wassermolekül sitzt über H-Brücken am Sulfat-Anion und lässt sich erst oberhalb von 200°C entfernen.
Die eigentliche Formel von wasserhaltigem Kupfersulfat wäre also [Cu(H 2 O) 4 ]SO 4 ·H 2 O.
Die Farbigkeit von Übergangsmetallkomplexen kommt durch die Beeinflussung der Elektronen des Zentralatoms durch das elektrische Feld von an das Zentralatom koordinierten Liganden zustande. Gehen diese Liganden "verloren" (wie im Beispiel von Kupfersulfat das Wasser), besteht kein elektrisches Ligandenfeld mehr und die Verbindung wird farblos.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, 2020)
werbung
Blaukraut-Indikator
Ein pH-Indikator ist ein Farbstoff, der auf saure oder basische Lösungen mit einer Farbänderung reagiert. Ein bekanntes Beispiel aus dem Haushalt ist Blaukraut bzw. Blaukrautsaft. Dieser wechselt in Anwesenheit von Säuren seine Farbe nach Rot, in Anwesenheit von Laugen nach Blau bis Grün - das ist übrigens auch der Grund für den Namensunterschied: Blau- und Rotkraut wachsen auf Böden mit unterschiedlichem pH-Wert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Ein pH-Indikator ist ein Farbstoff, der auf saure oder basische Lösungen mit einer Farbänderung reagiert. Ein bekanntes Beispiel aus dem Haushalt ist Blaukraut bzw. Blaukrautsaft. Dieser wechselt in Anwesenheit von Säuren seine Farbe nach Rot, erscheint im Neutralen Blau und in Anwesenheit von Laugen verfärbt er sich Grün bis Gelb. Somit erklärt sich auch der Unterschied zwischen Rotkraut und Blaukraut - es handelt sich hierbei um die selbe Pflanze, jedoch führt der pH-Wert des Bodens auf welchem sie wächst zu einer unterschiedlichen Farbe.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Blaukraut, Magnetrührer, Rührfisch, 400ml Becherglas, 5x 250ml Becherglas, Messer
Chemikalien
30% Salzsäure
Zitronensäure
Natriumhydrogencarbonat
Natriumhydroxid
Durchführung
Ein Teil des Blaukrauts wird in kleine Stücke geschnitten, in das Becherglas gegeben und auf dem Magnetrührer mit dest. Wasser ausgekocht, bis im Wasser eine violette Färbung auftritt.
Nach dem Dekantieren kann der Extrakt nun dazu verwendet werden, pH-Werte von anderen Flüssigkeiten zu untersuchen.
Dazu werden in die 5x 250ml Bechergläser jeweils die gleiche Menge an Extrakt eingefüllt. Dann werden nacheinander verdünnte Lösungen von Salzsäure, Zitronensäure, Natron sowie Natriumhydroxid hinzugegeben.
Entsorgung
Im Abguss.
Erklärung
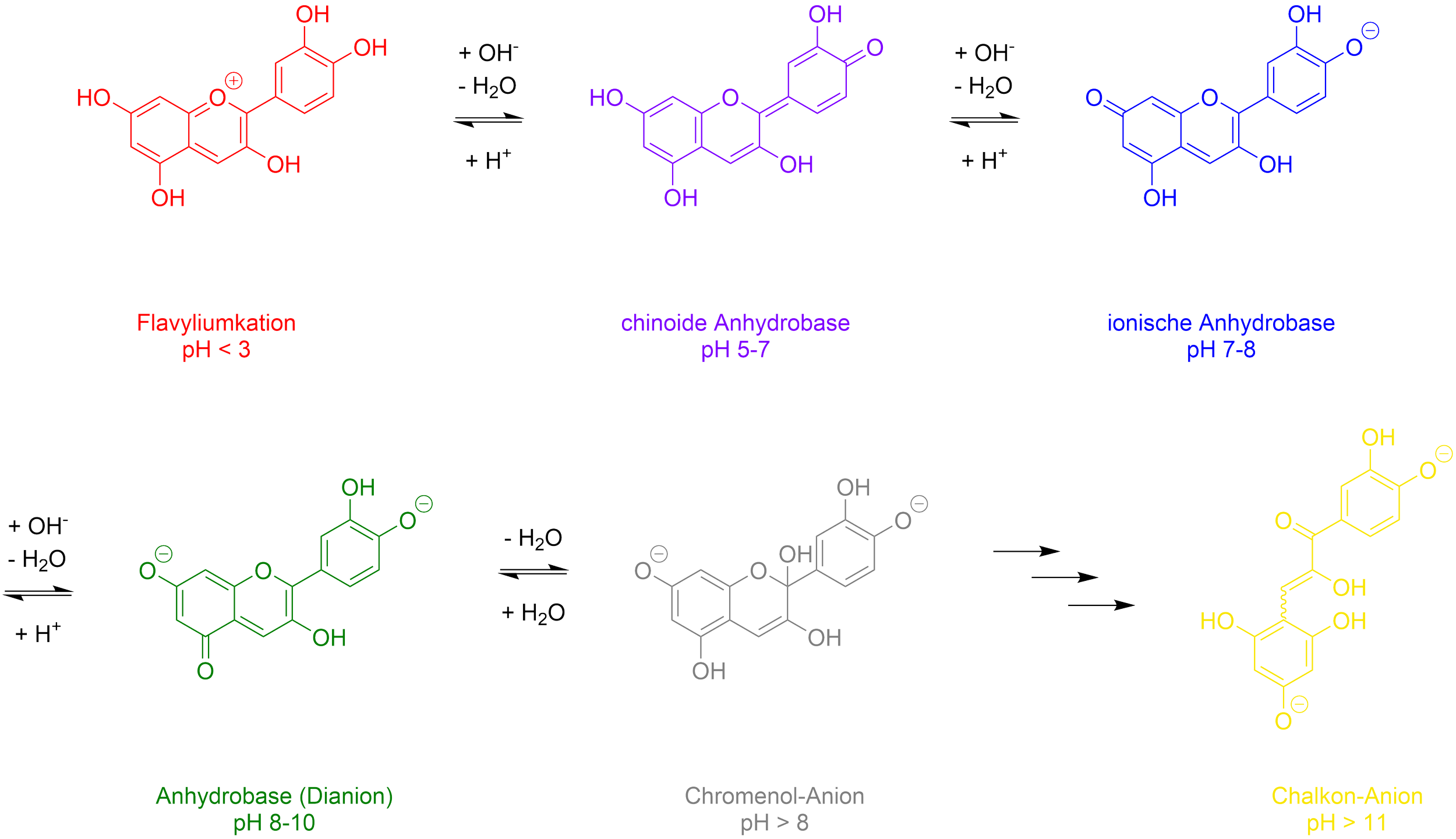
Bei pH-Werten < 3 liegt das im Blaukraut vorkommende Anthocyan Cyanidin als rotes Flavyliumkation vor. Zwischen pH-Werten von 5 und 7 liegt der Farbstoff als chinoide Anhydrobase vor und erscheint violett. Im leicht alkalischen Mileu kommt es zu einer Delokalisierung der π-Elektronen über die drei Sechsringe und die Sauerstoffatome der Phenolat-Gruppe, was zu einer blauen Färbung führt. Bei pH-Werten ab 8 liegt Cyanidin als grünes Dianion vor, welches mit einem farblosen Chromenol-Anion konkurriert. Im stark alkalischen Mileu kommt es zur hydrolytischen Öffnung des Pyranringes und das Molekül wird zu einem gelben Chalkon-Anion umgewandelt.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Papierchromatografie von Filzstiftfarbe
Die Chromatographie (v. chroma griechisch = Farbe & graphein griechisch = schreiben) ist ein genaues und einfaches chemisches Untersuchungsverfahren. Mit ihr lassen sich Reinstoffe (nur aus einem Stoff bestehend) oder Stoffgemische (aus mehreren Stoffen bestehend) auf Verunreinigungen untersuchen. Weiter kann man präparativ Stoffe voneinander trennen.
Unter Jüngeren sind Filzstifte sehr beliebte Malstifte. Mit dem hier angewandten Versuch einer Papierchromatographie kann sehr eindrucksvoll gezeigt werden, dass beispielsweise Schwarz nicht zu den Grundfarben der Farbenmischung gehört und leicht in seine Bestandteile (Mischfarben) aufgetrennt werden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Chromatographie (v. chroma griechisch = Farbe & graphein griechisch = schreiben) ist ein genaues und einfaches chemisches Untersuchungsverfahren. Mit ihr lassen sich Reinstoffe (nur aus einem Stoff bestehend) oder Stoffgemische (aus mehreren Stoffen bestehend) auf Verunreinigungen untersuchen. Weiter kann man präparativ Stoffe voneinander trennen.
Unter Jüngeren sind Filzstifte sehr beliebte Malstifte. Mit dem hier angewandten Versuch einer Papierchromatographie kann sehr eindrucksvoll gezeigt werden, dass beispielsweise Schwarz nicht zu den Grundfarben der Farbenmischung gehört und leicht in seine Bestandteile (Mischfarben) aufgetrennt werden kann.
Schwierigkeitsgrad
Experiment für zu Hause - einfach
Geräte
Filterpapier (weißes Kaffeefilterpapier/Löschpapier), Glasstab, Becherglas mit Wasser (Gefäß), Bunte (wasserlösliche!) Filzstifte (am besten funktionieren: Braun & Schwarz), Bleistift, Geodreieck
Durchführung
Aus dem Filterpapier wird ein länglicher Streifen ausgeschnitten, der in das Glas passt. Dann wird mit Hilfe des Geodreiecks und dem Bleistift eine gerade Linie ca. 1 cm über dem unteren Ende gezogen.
Mit jedem Filzstift, der analysiert werden soll, wird ein Punkt auf diese Linie gemacht – wobei mindestens 1 cm zum Rand sowie zu den anderen Punkten einzuhalten sind.
Das Filterpapier wird am oberen Ende umgeknickt und über den Glasstab gelegt. Das Becherglas wird so weit mit Wasser gefüllt, dass das Papier gerade noch ins Wasser eintaucht.
Das Papier wird ins Wasser gehängt. Es lässt sich beobachten, wie das Wasser am Filterpapier hochsteigt und auch über die Farbpunkte zieht. Das Filterpapier wird erst wieder aus dem Glas gezogen, wenn die „Laufmittelfont“ (Linie des steigenden Wassers) knapp unter dem oberen Ende des Filterpapiers ist.
Anmerkung
Die bunten Tupfer trennen sich in verschiedene bunte Farben auf. Je nach Fabrikat des Filzstifts entsteht ein unterschiedliches Farbmuster.
Entsorgung
Filterpapier im Hausmüll, Wasser im Abfluss
Erklärung
In der Chromatographie werden unterschiedliche Substanzen in der so genannten mobilen Phase (=Laufmittel) auf einer stationären Phase (= Filterpapier oä.) befördert. Aufgrund der Wechselwirkungen zwischen der Probe, der stationären Phase und der mobilen Phase werden einzelne Substanzen unterschiedlich schnell weitertransportiert und somit voneinander getrennt.
Die Farben in den meisten Filzstiften, insbesondere der Dunklen, werden aus unterschiedlichen Farben zusammengemischt. Die verschiedenen Farbanteile lösen sich zwar alle im Wasser, sie werden aber vom Filterpapier unterschiedlich stark „festgehalten“. Wenn das Wasser das Papier „hinaufkriecht“, benetzt es auch die Farbpunkte.
Das Ganze lässt sich mit einem reißenden Fluss (=Lösungsmittelfront) vergleichen. Dieser kann einiges an Treibgut (=Farbpartikel) mit sich führen. Die Geschwindigkeit, mit der das Treibgut weiterbewegt wird, hängt aber von der Art des Treibguts (Sandkörner werden schneller als Kieselsteine transportiert), von der Beschaffenheit des Flussbetts (raue Oberflächen erhöhen die Reibung des Treibguts und verringern somit die Geschwindigkeit des Abtransports) sowie von der Strömungsgeschwindigkeit ab.
Die Chromatographie wird z.B. in Forschungslaboren genutzt. Denn wenn ein neuer Stoff produziert wird, entstehen bei der chemischen Reaktion noch andere Substanzen. Chromatographische Methoden können dabei helfen, den gewünschten Stoff von den ungewünschten „Nebenprodukten“ abzutrennen.
Foto
Video
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Silberbesteck zum Glänzen bringen
Beim Reinigen von Silberbesteck wurden ganze Generationen von Hausfrauen „verschlissen“. Die Arbeit war anstrengend und wegen der geringen Nachhaltigkeit auch deprimierend: Egal, wie gut das Silber geputzt wurde - nach kurzer Zeit läuft es wieder an. Der Inbegriff einer Sisyphus Arbeit! Doch Silber sollte ja eigentlich so edel sein… Glücklicherweise braucht man mit etwas chemischem Wissen und ein paar einfachen Hausmitteln nie wieder lange Silberbesteck polieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Beim Reinigen von Silberbesteck wurden ganze Generationen von Hausfrauen „verschlissen“. Die Arbeit war anstrengend und wegen der geringen Nachhaltigkeit auch deprimierend: Egal, wie gut das Silber geputzt wurde - nach kurzer Zeit läuft es wieder an. Der Inbegriff einer Sisyphus Arbeit!
Doch Silber sollte ja eigentlich so edel sein… Glücklicherweise braucht man mit etwas chemischem Wissen und ein paar einfachen Hausmitteln nie wieder lange Silberbesteck polieren.
Schwierigkeitsgrad
Experiment für zu Hause - einfach
Geräte
Angelaufenes Silberbesteck, Gefäß, Alufolie
Chemikalien
Natriumchlorid (Kochsalz)
Durchführung
Das Silberbesteck wird in ein Gefäß, welches Innen mit Alufolie ausgekleidet wurde, gelegt. Nun wird mit heißem Salzwasser (5EL Salz auf 1L Wasser) aufgefüllt, bis alle Silberteile bedeckt sind.
Unmittelbar danach sind kleine Luftbläschen erkennbar und die schwarze Schicht beginnt sich zu lösen. Nach 5 Minuten kann das Besteck herausgenommen und nach kurzem Abwaschen wieder verwendet werden.
Entsorgung
Alufolie im Restmüll entsorgen und die Salzlösung gut verdünnt dem Abwasser zuführen.
Erklärung
Das Redox-Gleichgewicht dieser Reaktion liegt stark auf der linken Seite, das Silber sollte also als Edelmetall aufgrund seines hohen Redoxpotentials gegen eine Oxidation durch Sauerstoff stabil sein.
Wenn jedoch ein Stoff wie Schwefelwasserstoff, der mit Silber-Ionen schwerlösliche Verbindungen eingeht, anwesend ist, kann auch Sauerstoff das Silber oxidieren, denn die Bildung der Sulfide setzt Energie frei. Somit sinkt das Redoxpotential des Silbers von 0,8 Volt auf ca. 0,1 Volt (Zinn: 0,136 Volt) – das Metall wird scheinbar unedler.
Sobald Silber also in Gegenwart von Luftsauerstoff mit Schwefelwasserstoff in Kontakt kommt (z.B. mit Eiern oder Erbsensuppe), „läuft“ das Silber an – es bildet sich eine verfärbte Schicht.
Durch Kontakt mit Aluminium in einer Elektrolyt-Lösung wird ein Lokalelement gebildet und dadurch der Silbersulfidbelag elektrochemisch wieder zu metallischem Silber reduziert.
Dabei wird wieder Schwefelwasserstoff frei, wodurch es unangenehm riechen kann.
Der Vorteil dieser chemischen Methode im Gegensatz zum mechanischen Reinigen liegt darin, dass kein Silber verloren geht.
Fotos
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.