Cyanotypie
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Vor dem zweiten Weltkrieg und dem Aufkommen der Diazotypie, wurden z.B. Baupläne als Blaupausen durch Cyanotypie vervielfältigt. Heute hat dieses Verfahren maximal im künstlerischen Bereich Anwendungen, die zugrunde liegende chemische Reaktion ist dennoch ein schönes Chemie-Experiment.
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
Papier, Pinsel, 2x 50 mL Becherglas, Plexiglasplatte oder Büroklammern, Overhead-Folie, Permanentmarker
Chemikalien
Kaliumhexacyanoferrat(III)
Ammoniumeisen(III)-citrat
Durchführung
Vorbereitung
In dem ersten Becherglas werden 2 g Ammoniumeisen(III)-citrat und im zweiten 1,4 g Kaliumhexacyanoferrat(III) in jeweils 10 mL dest. Wasser gelöst. Beide Lösungen werden vereinigt und mit einem Pinsel auf Papier ausgestrichen. Mit der entsprechenden Menge können ca. 20 A4 Blätter hergestellt werden. Da die Reaktion erst bei Belichten mit UV-Licht beginnt, kann kurzzeitig unter Kunstlicht von Neonröhren gearbeitet werden. Die bestrichenen Blätter sollten aber unter Lichtausschluss getrocknet werden.
Belichtung
Auf Overheadfolien wird das zu übertragende Bild gezeichnet oder von einem Druck abgepaust. Das endgültige Bild wird ein Negativ der Skizze, da alle hellen Bereiche belichtet werden.
Die Overheadfolie wird dann auf das lichtempfindliche Papier gelegt und an einem sonnigen Tag draußen belichtet. Um eine gleichmäßige Auflage zu gewährleisten, kann der Aufbau zusätzlich mit einer Plexiglasplatte überdeckt werden. Alternativ ist auch das Fixieren der Folie am Papier mit Büroklammern an den Kanten möglich.
Nach 3-5 min ist die Reaktion abgeschlossen und das Papier wird in einer Wanne geeigneter Größe gewässert, dann unter fließendem Wasser gespült und zum Schluss getrocknet und ggf. gepresst.
Entsorgung
Kaliumhexacyanoferrat(III), Ammoniumeisen(III)-citrat und die daraus resultierenden Lösungen werden als anorganischer Schwermetallabfall entsorgt.
Unter UV-Licht wird das Eisen(III) im Ammoniumeisen(III)-citrat zu Eisen(II) reduziert:
Beim Wässern geht dieses in Lösung und trifft auf Kaliumhexacyanoferrat, wodurch der wasserunlösliche Feststoff Berliner Blau entsteht:
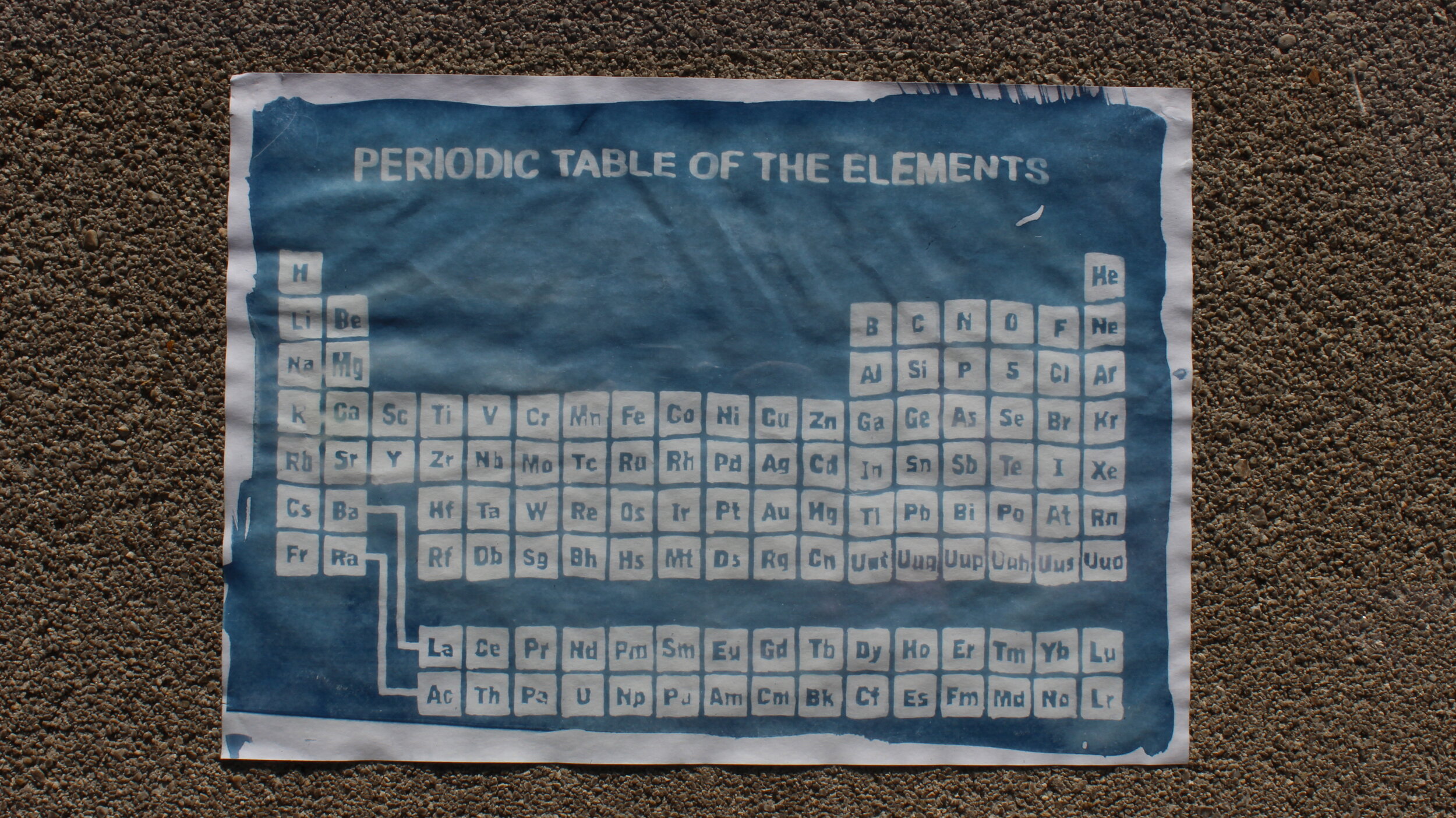
Fotos
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Kaliumhexacyanoferrat(III) (Kein gefährlicher Stoff nach GHS)
Ammoniumeisen(III)-citrat (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.