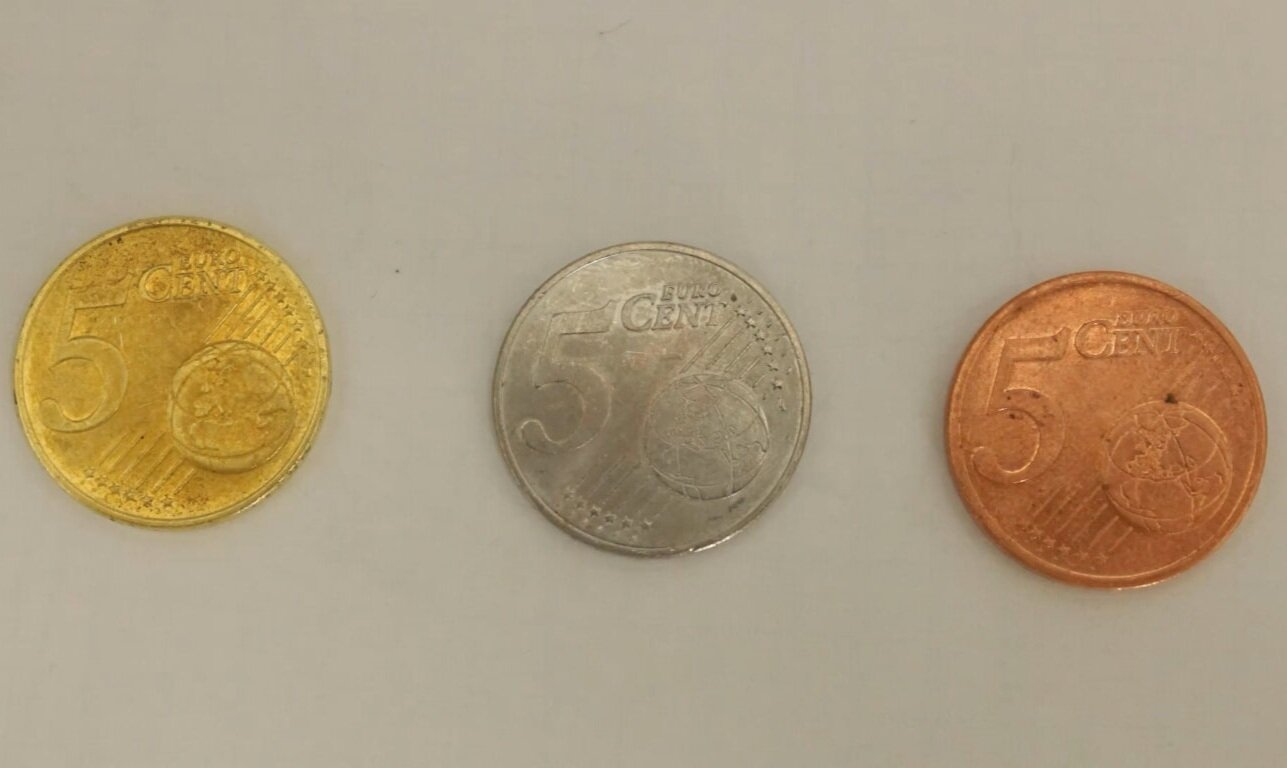Lithium in Wasser
Alkalimetalle bilden mit Wasser unter Freisetzung von Wasserstoff Alkalilaugen. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Lithium im Wasser demonstriert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser unter Freisetzung von Wasserstoff Alkalilaugen. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Lithium im Wasser demonstriert.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer, Streichhölzer
Chemikalien
Lithium
Durchführung
Die Wanne wird zu dreiviertel mit Wasser befüllt. Lithium wird mittels Pinzette und Messer in mehrere kleine Stücke (stecknadel- bis erbsengroß) zerteilt und diese anschließend mit einem Kuchentuch von der Schutzflüssigkeit befreit.
Lithium im direkten Kontakt mit Wasser:
Ein Stück Lithium wird mit einer Pinzette direkt auf die Wasseroberfläche gegeben. Das Lithium „tanzt“ unter Wasserstoffabgabe über die Wasseroberfläche, entzündet sich jedoch nicht von selbst.
Lithium auf Filterpapier im Wasser:
Nun wird ein Filterpapier auf die Wasseroberfläche gelegt, worauf ein Stück Lithium platziert wird. Wieder bildet sich Wasserstoff, doch trotz der Tatsache, dass sich das Stück diesmal nicht vom Fleck bewegt und es somit zu einer vielfach höheren Wasserstoffkonzentration kommt, beginnt das Lithium (anders als Natrium) nicht zu brennen.
Entzünden von Lithium im Wasser:
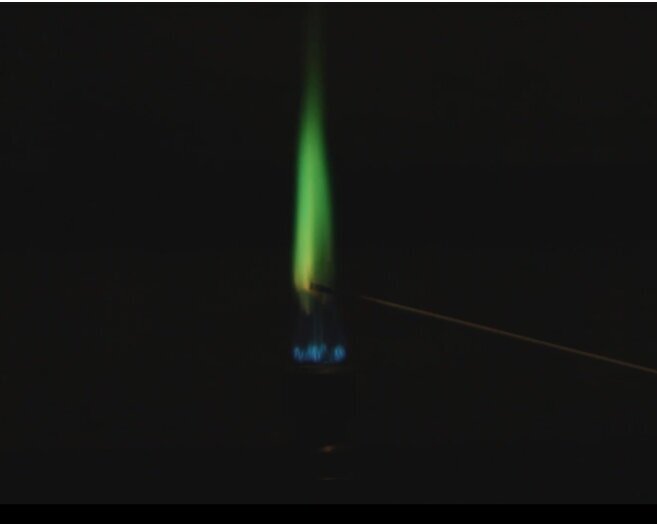
Es wird ein Stück Lithium direkt im Wasser platziert, diesmal jedoch sofort im Anschluss mittels Streichholz entzündet. Das Lithium entzündet sich und verbrennt mit charakteristisch roter Flamme.
Anmerkung
Zum Nachweis des entstehenden Lithiumhydroxids kann das Wasser in der Kunststoffwanne mit etwas Phenolphthalein-Lösung versetzt werden.
Entsorgung
Die entstandene Lauge wird neutralisiert und kann im Abguss entsorgt werden.
Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Lithiumstückchen zu quenchen.
Erklärung
Wenn Alkalimetalle wie Lithium mit Wasser in Kontakt kommen, läuft eine exotherme Reaktion unter Wasserstofffreisetzung ab.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Kerzentreppe
Mit einer Kerzentreppe lässt sich die Anwesenheit von Kohlenstoffdioxid nachweisen. Dabei wird sich die Tatsache zunutze gemacht, dass dieses eine höhere Dichte hat - also schwerer ist - als Luft. Wird Kohlenstoffdioxid in ein Glasgefäß mit Teelichtern auf unterschiedlichen Höhen eingeleitet, erlöschen diese nacheinander von unten nach oben.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Mit einer Kerzentreppe lässt sich die erstickende Wirkung von Kohlenstoffdioxid nachweisen. Dabei wird sich die Tatsache zunutze gemacht, dass dieses eine höhere Dichte hat - also schwerer ist - als Luft. Wird Kohlenstoffdioxid in ein Glasgefäß mit Teelichtern auf unterschiedlichen Höhen eingeleitet, erlöschen diese nacheinander von unten nach oben.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
500 mL Rundkolben, Becherglas 800/250/50 mL, Schlauchverbindungen, Aquarium, 3 Teelichter, Feuerzeug
Chemikalien
Trockeneis
Durchführung
In einen 500 mL Rundkolben wird Trockeneis gegeben und mittels heißem Wasser zu gasförmigem CO2 sublimiert. Dieses wird via Schlauchverbindungen in das Aquarium eingeleitet.
Es lässt sich beobachten, dass die Teelichter - eins nach dem anderen - von unten nach oben erlöschen.
Entsorgung
Übrig gebliebene Trockeneisreste können in warmem Wasser vollständig sublimiert werden. Auf gute Belüftung achten!
Erklärung
Kohlenstoffdioxid besitzt eine höhere Dichte als die Umgebungsluft, wodurch es sich im Aquarium unten sammelt und so langsam den Kerzen den zum Brennen benötigten Sauerstoff verdrängt.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Trockeneis (kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Reaktion von Magnesium mit Trockeneis
Ein Magnesiumbrand kann nicht mit einem CO2-Feuerlöscher gelöscht werden. Das folgende Experiment soll das veranschaulichen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Ein Magnesiumbrand kann nicht mit einem CO2-Feuerlöscher gelöscht werden. Das folgende Experiment soll das veranschaulichen.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
Feuerfeste Unterlage, Brenner, Metallbrandfeuerlöscher
Chemikalien
2 Trockeneisplatten
Magnesiumspäne
Durchführung
Auf eine feuerfeste Unterlage wird eine Trockeneisplatte gelegt. In die Mitte der Platte wird ein Spatel voll Magnesiumspäne gegeben und diese mit dem Brenner entzündet. Hierbei sollte kein Kartuschenbrenner verwendet werden, da man diese nicht kippen darf.
Entsorgung
Übrig gebliebene Trockeneisreste können in warmem Wasser vollständig sublimiert werden.
Erklärung
Bei der Verbrennung von Magnesium entsteht sehr stabiles Magnesiumoxid. Bei dessen Bildung kann Magnesium Sauerstoff nicht nur aus der (Umgebungs-)Luft, sondern auch aus sauerstoffhaltigen Verbindungen wie beispielsweise Kohlenstoffdioxid beziehen.
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Trockeneis (kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Luminol-Springbrunnen
In diesem dritten Experiment unserer Springbrunnen-Variationen greifen wir auf den Mechanismus des Ammoniakspringbrunnens zurück, erweitern diesen aber mit der Chemolumineszenz von Luminol.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
In diesem dritten Experiment unserer Springbrunnen-Variationen greifen wir auf den Mechanismus des Ammoniakspringbrunnens zurück, erweitern diesen aber mit der Chemolumineszenz von Luminol.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
1 Rundkolben 250 mL, 1 Rundkolben 500 ml, 2 Bechergläser 400 mL, 2 Septen, Stativmaterial mit 2 Klemmen, Spritzen + Kanülen, Schlauchverbindungen, Membranvakuumpumpe
Chemikalien
Ammoniumchlorid
Natriumhydroxid
Luminol
30% Wasserstoffperoxid
Kaliumhexacyanoferrat (III)
Durchführung
Die Befüllung des 500 mL Rundkolbens mit Ammoniak erfolgt gleich wie beim Ammoniak-Springbrunnen.
Ist der Kolben befüllt werden alle Nadeln aus dem Septum entfernt und der Kolben umgedreht - also mit der Öffnung nach unten befestigt.
Anschließend werden zwei mit je einem Schlauch verbundene Spritzen durch das Septum gestochen. Die Schläuche am anderen Ende werden in zwei 400 mL Bechergläser gegeben.
Becherglas I: 2,5 mL 10 % erkaltete Natriumhydroxid-Lösung werden mit 197,5 mL Wasser verdünnt und darin 0,05 g Luminol gelöst.
Becherglas II: 0,75 g Kaliumhexacyanoferrat (III) werden in 199,2 mL Wasser gelöst und 1,5 mL 30% Wasserstoffperoxid hinzugefügt.
Abschließend werden mit einer weiteren Spritze wenige Tropfen Wasser in den Kolben gespritzt und so der Prozess gestartet.
Durch den entstehenden Unterdruck steigt das Wasser langsam nach oben. Sobald die ersten Tropfen in den Rundkolben gelangt sind, bilden sich zwei zunehmend kräftiger werdende Fontänen - der „Springbrunneneffekt“ tritt ein. Sobald die beiden Lösungen aufeinandertreffen, kommt es zudem zu einer bläulich leuchtenden Chemolumineszenz-Reaktion. Nach ca. 5 min verliert der Springbrunnen an Druck und der Versuch ist beendet.
Entsorgung
Nach dem Neutralisieren können die stark verdünnten Lösungen über das Abwasser entsorgt werden.
Erklärung
Ammoniak ist sehr gut in Wasser löslich. So lösen sich bei 0 °C in einem Liter Wasser 1176 Liter, bei 20 °C immerhin noch 702 Liter Ammoniak. Sobald also das Ammoniakgas mit Wasser in Berührung kommt, löst es sich sofort und es entsteht ein Vakuum. Dadurch beginnt das Wasser im Schlauch zu steigen und der Springbrunnen beginnt.
Luminol wird durch das Natriumhydroxid zu einem Dianion deprotoniert und dieses mit Wasserstoffperoxid zum 3-Aminophthalat-Dianion unter Abgabe von Stickstoff oxidiert. Das Dianion ist dabei in einem angeregten Zustand und gibt beim Wechsel in den Grundzustand Energie in Form von Licht ab. Das Kaliumhexacyanoferrat dient als Katalysator und sorgt für eine höhere Intensität, verkürzt aber die Leuchtdauer. Der genaue Mechanismus der Oxidation ist noch unbekannt, es wird aber angenommen, dass die Oxidation durch ein Hyperoxidradikalion (O2-) ermöglicht wird – Kaliumhexacyanoferrat sollte die Freisetzung dieser Radikale aus dem Wasserstoffperoxid fördern.
Fotos
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Luminol (kein gefährlicher Stoff nach GHS)
Kaliumhexacyanoferrat (III) (kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
HCl-Springbrunnen
Im zweiten Experiment unserer Springbrunnen-Variationen wird die starke Neigung von Chlorwasserstoff, sich in Wasser zu lösen, veranschaulicht.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im zweiten Experiment unserer Springbrunnen-Variationen wird die starke Neigung von Chlorwasserstoff, sich in Wasser zu lösen, veranschaulicht.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
1 Rundkolben 250 mL, 1 Rundkolben 500 ml, 1 Becherglas 400 mL, 2 Septen, Stativmaterial mit 2 Klemmen, Spritzen + Kanülen, Schlauchverbindungen, Membranvakuumpumpe
Chemikalien
Natriumchlorid
Schwefelsäure (96%)
Methylrot-Indikator
Durchführung
In einen 250 mL Rundkolben werden 5 g Natriumchlorid vorgelegt und mit einem Septum verschlossen. Durch dieses Septum wird eine Kanüle, welche über eine Spritze mit einem Schlauch verbunden ist, gesteckt. Das andere Ende des Schlauches wird ebenfalls über eine Spritze mit einer Kanüle verbunden. Anschließend wird langsam mit einer 5 mL Spritze konzentrierte Schwefelsäure hinzugetropft, bis aus der Kanüle am Ende der Schlauchverbindung Chlorwasserstoff strömt (ein befeuchtetes pH-Indikatorpapier verfärbt sich bei Anwesenheit von Chlorwasserstoff rot).
Der 500 mL Rundkolben wird mit der Öffnung nach oben mit dem Stativmaterial befestigt und ebenfalls mit einem Septum verschlossen. Mittels Membranvakuumpumpe wird dieser über eine Kanüle evakuiert und anschließend über die Schlauchverbindung mit dem anderen Kolben verbunden und so mit Chlorwasserstoff befüllt. Mit einer weiteren Kanüle im Septum des 500 mL Kolbens kann auch hier überprüft werden, ob der Kolben mit Chlorwasserstoff befüllt ist: Solange ein Unterdruck am Ende der Kanüle spürbar ist, ist der Kolben noch nicht komplett befüllt. Außerdem zeigt auch hier ein befeuchtetes Stück pH-Indikatorpapier ausströmenden Chlorwasserstoff an.
Ist der Kolben befüllt werden alle Nadeln aus dem Septum entfernt und der Kolben umgedreht - also mit der Öffnung nach unten befestigt.
Anschließend wird eine mit einem Schlauch verbundene Spritze durch das Septum gestochen. Der Schlauch am anderen Ende wird in ein 400 mL Becherglas, welches mit Wasser und wenigen Tropfen Methylrot-Indikator befüllt ist, gegeben. Abschließend werden mit einer weiteren 1 mL Spritze durch das Septum wenige Tropfen Wasser in den Kolben gespritzt und so der Prozess gestartet.
Durch den entstehenden Unterdruck steigt das Wasser langsam nach oben. Sobald die ersten Tropfen in den Rundkolben gelangt sind, bildet sich eine zunehmend kräftiger werdende rote Wasserfontäne - der „Springbrunneneffekt“ tritt ein. Nach ca. 10 min verliert der Springbrunnen an Druck und der Versuch ist beendet.
Entsorgung
Nach dem Neutralisieren können die stark verdünnten Lösungen über das Abwasser entsorgt werden.
Erklärung
Chlorwasserstoff ist sehr gut in Wasser löslich. So lösen sich bei 0 °C in einem Liter Wasser 525 Liter, bei 20 °C immerhin noch 442 Liter. Sobald also Chlorwasserstoff-Gas mit Wasser in Berührung kommt, löst es sich sofort und es entsteht ein schwaches Vakuum.
Dadurch beginnt das Wasser im Schlauch zu steigen und der Springbrunnen beginnt. Da bei der Lösung von Chlorwasserstoff in Wasser Salzsäure entsteht und diese sauer ist, führt dies zu einem Farbumschlag des Indikators.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Methylrot-Indikator (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Ammoniak-Springbrunnen
In diesem ersten Experiment unserer Springbrunnen-Variationen wird die starke Neigung von Ammoniak, sich in Wasser zu lösen, veranschaulicht.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
In diesem ersten Experiment unserer Springbrunnen-Variationen wird die starke Neigung von Ammoniak, sich in Wasser zu lösen, veranschaulicht.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
1 Rundkolben 250 mL, 1 Rundkolben 500 ml, 1 Becherglas 400 mL, 2 Septen, Stativmaterial mit 2 Klemmen, Spritzen + Kanülen, Schlauchverbindungen, Membranvakuumpumpe
Chemikalien
Ammoniumchlorid
Natriumhydroxid
Phenolphtalein-Indikator
Durchführung
In einen 250 mL Rundkolben werden 4 g Ammoniumchlorid vorgelegt und mit einem Septum verschlossen. Durch dieses Septum wird eine Kanüle, welche über eine Spritze mit einem Schlauch verbunden ist, gesteckt. Das andere Ende des Schlauches wird ebenfalls über eine Spritze mit einer Kanüle verbunden. Anschließend wird langsam mit einer 5 mL Spritze konzentrierte Natronlauge hinzugetropft, bis aus der Kanüle am Ende der Schlauchverbindung Ammoniak strömt (ein befeuchtetes pH-Indikatorpapier verfärbt sich bei Anwesenheit von Ammoniak blau).
Der 500 mL Rundkolben wird mit der Öffnung nach oben mit dem Stativmaterial befestigt und ebenfalls mit einem Septum verschlossen. Mittels Membranvakuumpumpe wird dieser evakuiert und anschließend über die Schlauchverbindung mit dem anderen Kolben verbunden und so mit Ammoniak befüllt. Mit einer weiteren Kanüle im Septum des 500 mL Kolbens kann auch hier überprüft werden, ob der Kolben mit Ammoniak befüllt ist: Solange ein Unterdruck am Ende der Kanüle spürbar ist, ist der Kolben noch nicht komplett mit Ammoniak befüllt. Außerdem zeigt auch hier ein befeuchtetes Stück pH-Indikatorpapier ausströmendes Ammoniakgas an.
Ist der Kolben befüllt werden alle Nadeln aus dem Septum entfernt und der Kolben umgedreht - also mit der Öffnung nach unten befestigt.
Anschließend wird eine mit einem Schlauch verbundene Spritze durch das Septum gestochen. Der Schlauch am anderen Ende wird in ein 400 mL Becherglas, welches mit Wasser und wenigen Tropfen Phenolphtalein-Indikator befüllt ist, gegeben. Abschließend werden mit einer weiteren Spritze wenige Tropfen Wasser in den Kolben gespritzt und so der Prozess gestartet.
Durch den entstehenden Unterdruck steigt das Wasser langsam nach oben. Sobald die ersten Tropfen in den Rundkolben gelangt sind, bildet sich eine zunehmend kräftiger werdende violette Wasserfontäne - der „Springbrunneneffekt“ tritt ein. Nach ca. 5 min verliert der Springbrunnen an Druck und der Versuch ist beendet.
Entsorgung
Nach dem Neutralisieren können die stark verdünnten Lösungen über das Abwasser entsorgt werden.
Erklärung
Ammoniak ist sehr gut in Wasser löslich. So lösen sich bei 0 °C in einem Liter Wasser 1176 Liter, bei 20 °C immerhin noch 702 Liter Ammoniak. Sobald also das Ammoniakgas mit Wasser in Berührung kommt, löst es sich sofort und es entsteht ein Vakuum.
Dadurch beginnt das Wasser im Schlauch zu steigen und der Springbrunnen beginnt. Da Ammoniaklösung basisch ist, führt dies zu einem Farbumschlag des Indikators.
Fotos
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemisches Gleichgewicht - Stickstoffdioxid/Distickstofftetroxid
In diesem Experiment wird eindrucksvoll demonstriert, dass sich das chemische Gleichgewicht in einem geschlossenen System durch Ausübung eines Zwangs (Le Chatelier) - in diesem Fall einer Temperaturänderung - verschieben lässt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
In diesem Experiment wird eindrucksvoll demonstriert, dass sich das chemische Gleichgewicht in einem geschlossenen System durch Ausübung eines Zwangs (Le Chatelier) - in diesem Fall einer Temperaturänderung - verschieben lässt.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
3 Bechergläser 250ml, Pinzette
Chemikalien
Stickstoffdioxid-/Distickstofftetroxid-Ampulle
Durchführung
In den zwei Bechergläsern wird Wasser mit unterschiedlichen Temperaturen vorbereitet. Dazu wird in das Erste kochendes und in das Zweite Eiswasser gegeben. Nun wird die Ampulle mit einer Pinzette nacheinander in die Bechergläser getaucht. Sofort lässt sich jeweils eine Farbänderung feststellen.
Erklärung
Stickstoffdioxid ist braun und befindet sich mit Distickstofftetraoxid (farblos) im Gleichgewicht.
Da die Hinreaktion exotherm ist, liegt bei höheren Temperaturen hauptsächlich Stickstoffdioxid vor. Somit verfärbt sich das Gas in der Ampulle bei hohen Temperaturen zu dunkelbraun.
Im Gegensatz dazu verläuft die Rückreaktion endotherm, wodurch sich das Gleichgewicht sich in Richtung Distickstofftetraoxid verschiebt - bei kühleren Temperaturen erscheint das Gas deshalb beinahe farblos.
Bei Raumtemperatur liegen beide Verbindungen vor, was zu einer leicht bräunlichen Farbe führt.
Fotos
Video
Literatur
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Warmer Eiszapfen
Im Winter gehören die Eiszapfen genauso wie die Kälte einfach dazu. Doch in diesem Experiment stellen wir wortwörtlich alles auf den Kopf. Ein Eiszapfen wächst entgegen der Schwerkraft nach oben und wird auch noch sehr warm!
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im Winter gehören die Eiszapfen genauso wie die Kälte einfach dazu. Doch in diesem Experiment stellen wir wortwörtlich alles auf den Kopf. Ein Eiszapfen wächst entgegen der Schwerkraft nach oben und wird auch noch sehr warm!
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Becherglas 500 ml, Erlenmeyerkolben 500 ml, Magnetrührer und Magnetrührstäbchen, Petrischale, Trichter, Filterpapier, Uhrglasschale, Waage, (Infrarotthermometer)
Chemikalien
Natriumacetat-Trihydrat
Durchführung
Herstellung der Natriumacetatlösung:
In einem Becherglas wird 100 g Natriumacetat-Trihydrat mit einem Magnetrührstäbchen auf dem Magnetrührer erhitzt.
Das Natriumacetat-Trihydrat beginnt bei ca. 56°C sich im eigenen Kristallwasser zu lösen. Sobald die Lösung siedet, wird so lange Wasser zugetropft, bis kein fester Rückstand mehr sichtbar ist.
Um eventuelle Rückstände und Verunreinigungen zu beseitigen wird heiß filtriert. In den sauberen (!) bereit gehaltenen Erlenmeyerkolben wird bodenbedeckt Wasser vorgelegt und dieser auf den Magnetrührer gestellt. Dann wird der Trichter mit dem Filterpapier darauf platziert und sobald das Wasser im Erlenmeyerkolben siedet die Lösung vorsichtig filtriert. Der Trichter wird dabei mit einer passenden Uhrglasschale bedeckt, um Wärmeverluste durch Verdunstung zu minimieren.
Warmer Eiszapfen:
In eine Petrischale wird ein Kristallisationskeim (wenige Kristalle Natriumacetat-Trihydrat) gegeben. Dann wird vorsichtig die Natriumacetatlösung aus dem Erlenmeyerkolben auf den Kristallisationskeim gegossen.
Ist der Eiszapfen fertig aufgebaut kann mit einem Infrarotthermometer die Temperatur gemessen werden.
Anmerkung
Beim „Aufbau“ des „Eiszapfens“ muss auf einen Abstand zwischen Erlenmeyerkolben und „Eiszapfen“ geachtet werden – sonst kristallisiert die Flüssigkeit im Gefäß aus!
Entsorgung
Der Eiszapfen kann für eine erneute Verwendung wieder in den Erlenmeyerkolben gegeben und durch Erhitzen verflüssigt werden.
Ansonsten lässt sich der ausgehärtete Eiszapfen unbedenklich im Restmüll entsorgen.
Erklärung
Die Löslichkeit von Stoffen in Wasser ist temperaturabhängig. Bei höheren Temperaturen geht mehr Substanz in Lösung als bei niedrigen.
Wird nun bei einer sehr hohen Temperatur mehr Natriumacetat gelöst als bei Raumtemperatur normalerweise möglich wäre und die Flüssigkeit langsam abgekühlt, entsteht durch das Nichtvorhandensein eines Kristallisationskeimes eine übersättigte Lösung.
Sobald ein Festkörper (z.B. Natriumacetat-Kristall, großes Staubkorn) mit der Lösung in Berührung kommt, kommt es zur sofortigen Kristallisation unter Wärmeausbildung, die zuvor gespeichert wurde. Dieser Effekt wird sich beispielsweise bei Taschenwärmern zunutze gemacht.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumacetat Trihydrat (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
"Versilbern/-golden" einer Kupfermünze
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Schwierigkeitsgrad
Schülerversuch - mittel
Geräte
Becherglas, Tiegelzange, Magnetrührer, Magnetrührstäbchen, Kupfermünzen, Bunsenbrenner, Thermometer
Chemikalien
Kaliumhydroxid
Zinkpulver
Ethanol
Durchführung
Eine Kupfermünze wird in ein kleines Becherglas mit 100 mL 10 %iger Kalillauge (hergestellt aus 10 g Kaliumhydroxid und 90 mL Wasser) und 6 g Zinkpulver gegeben. Die Kalilauge sollte dabei eine Temperatur von 80 °C aufweisen. Nach 2-3 Minuten (wobei längere Einwirkzeiten das Ergebnis verbessern) hat eine Zinkschicht die gesamte Kupfermünze bedeckt. Diese wird mit einer Tiegelzange herausgenommen und durch Putzen mit Küchenrolle von überschüssigem Zink und Wasser befreit. Anschließend wird die Münze so lange in der Brennerflamme erwärmt, bis sie vollständig „vergoldet“ erscheint.
Entsorgung
Die überschüssige Lösung im Sammelbehälter für giftige anorganische Rückstände sowie Schwermetall-Salze und ihre Lösungen entsorgen.
Hinweis
Vor dem Versuch unbedingt die Kupfermünzen gut mit Spülmittel oder Ethanol reinigen und nur mit Handschuhen berühren!
Erklärung
Das Zinkpulver ist an der Oberfläche mit einer festen Zinkoxid- (ZnO) Schicht überzogen und somit passiviert. Dieses ZnO geht im basischen Milieu als Tetrahydroxozinkat in Lösung und scheidet sich an der Kupfermünze ab. Das steht im Widerspruch mit den Standardpotentialen, weil sich ein unedleres Metall (Zink) am edleren Metall (Kupfer) abscheidet. Tetrahydroxozinkat als Komplex hat aber ein anderes Standardpotential als Zink, weshalb Kupfer „unedler“ als der Komplex ist und die Reaktion abläuft.
Durch das Erhitzen der Münzen im Bunsenbrenner wird die Bildung einer Legierung zwischen den zwei Metallen – Messing - beschleunigt. Es kommt zu einem typischen Metallgitter aus verschiedenen Metallionen (Zn und Cu) und freibeweglichen Elektronen.
Foto
Video
Quelle
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Entfärben von Cola
Aktivkohle verwendet man im Labor bzw. in der organischen Synthesechemie, um Verfärbungen - beispielsweise beim Umkristallisieren - zu entfernen. Das zugrunde liegende Trennverfahren – die Adsorbtion – ist technisch höchst relevant und soll hier demonstriert werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Aktivkohle verwendet man im Labor bzw. in der organischen Synthesechemie, um Verfärbungen - beispielsweise beim Umkristallisieren - zu entfernen. Das zugrunde liegende Trennverfahren – die Adsorption – ist technisch höchst relevant und soll hier demonstriert werden.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
2x 50 mL Erlenmeyerkolben, 2x Trichter, Filterpapier, Spatel
Chemikalien
Aktivkohle (pulv.)
Durchführung
Ungefähr 30 mL Cola werden in einen Erlenmeyerkolben gegeben und darin 2-3 Spatel Aktivkohle suspendiert. Wird die Aktivkohle dann durch Filtration entfernt, ist das anfänglich schwarze Cola farblos.
Anmerkung
Die Filtration gelingt am besten, wenn drei Filter ineinander gestapelt und vor der Filtration mit dest. Wasser angefeuchtet werden.
Entsorgung
Alle Rückstände werden entweder im Ausguss oder Hausmüll entsorgt.
Erklärung
Aktivkohle ist sehr poröser Kohlenstoff, mit einer Oberfläche von 300-2000 m2/g. Viele Stoffe (wie z.B. der Farbstoff der Cola) lagern sich durch Adhäsion an dieser Oberfläche an und werden „aus dem Verkehr gezogen“. Die Einsatzgebiete von Aktivkohle sind sehr weitläufig, exemplarisch sind die folgenden erwähnenswert:
Medizin: Bindung von oral aufgenommenen Giftstoffen
Technik: Reinigung von Flüssigkeiten und Gasen (z.B. Giftstoffe aus der Luft in
Gasmaskenfilter)Katalyse: Trägermaterial für Edelmetallkatalysatoren (beispielsweise Pd/C für Hydrierungen)
Foto
Video
Gefährdungsbeurteilung
Aktivkohle (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Kalium in Wasser
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Kalium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Kalium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Kalium im Wasser veranschaulicht.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer
Chemikalien
Kalium
0,1% Phenolphthalein-Lsg. (ethanolisch)
Hinweis
Durchführung
Die Wanne wird zu dreiviertel mit Wasser gefüllt und ein Filterpapier in die Mitte der Wanne auf die Wasseroberfläche gelegt. Nun wird ein ca. stecknadelkopfgroßes Stück Kalium – welches vorher mit dem Messer entkrustet und mit Küchenrolle von der Schutzflüssigkeit befreit wurde - vorsichtig auf das Filterpapier gelegt. Das Kalium entzündet sich sofort bei Kontakt mit Wasser und verbrennt mit einer lila Flamme. Das Wasser wird nach der Reaktion mit ein paar Tropfen Phenolphthalein-Lösung versetzt – ein Farbumschlag ist zu beobachten.
Anmerkung
Der Versuch muss unbedingt abseits von brennbaren Gegenständen durchgeführt werden!
Entsorgung
Die entstandene Kalilauge wird neutralisiert und kann im Abguss entsorgt werden. Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Kaliumstückchen zu entfernen.
Erklärung
Wenn Alkalimetalle wie Kalium mit Wasser in Kontakt kommen, läuft eine heftige exotherme Reaktion unter Wasserstofffreisetzung ab.
Das entstandene Kaliumhydroxid löst sich im Wasser und bildet so eine schwache Kalilauge, darum färbt sich Phenolphthalein violett.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank + Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Flüssig-Flüssig-Extraktion
Die Flüssig-Flüssig-Extraktion ist eine klassische Trennmethode in der organischen Synthesechemie mit der häufig Reaktionsgemische aufgearbeitet werden. Dabei wird die unterschiedliche Löslichkeit von Stoffen in zwei nicht miteinander mischbaren Lösungsmitteln (z.B. Wasser/Cyclohexan) genutzt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Flüssig-Flüssig-Extraktion ist eine klassische Trennmethode in der organischen Synthesechemie mit der häufig Reaktionsgemische aufgearbeitet werden. Dabei wird die unterschiedliche Löslichkeit von Stoffen in zwei nicht miteinander mischbaren Lösungsmitteln (z.B. Wasser/Cyclohexan) genutzt.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
2x 25 mL Erlenmeyerkolben, 100 mL Scheidetrichter mit Stopfen, Stativmaterial
Chemikalien
Iod
Kaliumiodid
Cyclohexan
Natriumthiosulfat
Durchführung
In einem 25 mL Erlenmeyerkolben werden in 10 mL dest. Wasser nacheinander ein Spatel Kaliumiodid und eine Spatelspitze Iod gelöst. Im anderen Erlenmeyerkolben werden 10 mL Cyclohexan vorbereitet.
In den Scheidetrichter wird zuerst die Iod-Lösung und dann das farblose Cyclohexan hinzugegeben. Nach kräftigem Ausschütteln ist geht das Iod in die organische Phase über – diese färbt sich intensiv violett – und die wässrige Phase ist weniger intensiv braun gefärbt.
Entsorgung
In den Scheidetrichter wird etwas verdünnte Natriumthiosulfat-Lösung gegeben, wodurch sich nach dem Schütteln beide Phasen entfärben. Diese beiden Phasen werden getrennt: Das Cyclohexan lässt man im Abzug verdunsten und die wässrige Phase kann am nächsten Tag (nachdem sich eventuell gelöstes Cyclohexan verflüchtigt hat) gut verdünnt im Ausguss entsorgt werden.
Erklärung
Iod ist in Wasser nahezu unlöslich, jedoch in organischen Lösungsmitteln gut löslich. Das hinzugegebene Kaliumiodid bildet gemeinsam mit dem Iod in einer Gleichgewichtsreaktion wasserlösliche Polyiodidionen:
Da es sich um eine Gleichgewichtsreaktion handelt, ist elementares Iod verfügbar und durch die bessere Löslichkeit in organischen Lösungsmitteln extrahierbar. Dies lässt sich an der violetten Färbung des Cyclohexans erkennen.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumthiosulfat (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Natrium in Wasser
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann mit diesem Experiment unserer Reihe Alkalimetalle in Wasser das Verhalten von Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstriert werden.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer
Chemikalien
Natrium
0,1% Phenolphthalein-Lsg. (ethanolisch)
Durchführung
Die Wanne wird zu dreiviertel Wasser gefüllt und ein Filterpapier in die Mitte der Wanne auf die Wasseroberfläche gelegt. Nun wird das ca. erbsengroße Stück Natrium – welches vorher mit dem Messer entkrustet und mit Küchenrolle von der Schutzflüssigkeit befreit wurde - vorsichtig auf das Filterpapier gelegt. Nach einer kurzen Induktionsperiode brennt das Natrium ab und explodiert am Ende.
Das Wasser wird nach der Reaktion mit ein paar Tropfen Phenolphthalein-Lösung versetzt – ein Farbumschlag ist zu beobachten.
Anmerkung
Der Versuch muss unbedingt abseits von brennbaren Gegenständen durchgeführt werden!
Entsorgung
Die Natronlauge wird neutralisiert und kann im Abguss entsorgt werden.
Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Natriumstückchen zu entfernen.
Größere Mengen Natrium werden zuerst mit Isopropanol und dann vorsichtig mit Wasser versetzt. Die Lösung kommt neutral in den Ausguss.
Erklärung
Wenn Alkalimetalle wie Natrium mit Wasser in Kontakt kommen, läuft eine heftige exotherme Reaktion unter Wasserstofffreisetzung ab.
Durch das Filterpapier wird das Natrium am gleichen Ort fixiert. Der entstehende Wasserstoff verdünnt sich daher nicht, erreicht die untere Explosionsgrenze und entzündet sich.
Das entstandene Natriumhydroxid löst sich im Wasser und bildet so eine schwache Natronlauge, darum färbt sich Phenolphthalein violett.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank und Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Lumineszenz von Singulett-Sauerstoff
Sauerstoff ist das häufigste Element auf der gesamten Erde mit 32,4% Massenanteil. Das liegt daran, dass die meisten Metalle als oxidische Erze vorkommen. In unserem Sonnensystem ist es nach Wasserstoff und Helium das dritthäufigste Element - allerdings mit nur 0,8 %.
Sauerstoff kommt dabei als paramagnetischer Triplett-Sauerstoff vor. Es gibt aber noch eine andere, energiereichere Form des Sauerstoffs, den Singulett-Sauerstoff. Dieser ist äußerst kurzlebig (ca. 10-4 Sekunden) und wandelt sich in Triplett Sauerstoff um, wobei rotes Licht emittiert wird.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Sauerstoff ist das häufigste Element auf der gesamten Erde mit 32,4% Massenanteil. Das liegt daran, dass die meisten Metalle als oxidische Erze vorkommen. In unserem Sonnensystem ist es nach Wasserstoff und Helium das dritthäufigste Element - allerdings mit nur 0,8 %.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
500 mL Zweihalskolben, Tropftrichter mit Druckausgleich, Übergangsstück mit Schlaucholive, 250 mL Gaswaschflasche, PVC-Schlauch, Laborstativset, 250 mL Erlenmeyerkolben, 50 mL Erlenmeyerkolben, 50 mL Messzylinder, Waage, Spatel
Chemikalien
Kaliumpermanganat
30% Wasserstoffperoxid
Natriumhydroxid
konz. 32% Salzsäure
Hinweise
Für den Versuch muss ein sehr starker Chlorgasstrom erzeugt werden. Arbeiten im Abzug!
Durchführung
20g Natriumhydroxid werden in einem 250 mL Erlenmeyerkolben mit 140 mL Wasser versetzt und im Kühlschrank (oder alternativ in einem Eisbad) gekühlt. In einen 50 mL Erlenmyerkolben werden 30 mL 30% Wasserstoffperoxid gegeben und ebenfalls gekühlt.
In der Zwischenzeit wird eine Gasentwicklerapparatur wie folgt aufgebaut: In einen 500 mL Zweihalskolben werden 20g Kaliumpermanganat eingewogen und auf den mittleren Hals ein Tropftrichter, der mit 100 mL konz 31% Salzsäure gefüllt ist, aufgesetzt. Auf den Seitenhals kommt ein Übergangsstück mit Schlaucholive. Alle Schliffe werden mit Klemmen gesichert.
Eine 250 mL Gaswaschflasche wird mit einem zweiten Laborstativ gesichert, mit den gut gekühlten Lösungen beschickt und an den Gasentwickler angeschlossen (Unbedingt die korrekte Ausrichtung beachten). Das kurze Rohr der Waschflasche wird mit einem Schlauch versehen, der in den Abzugsschacht mündet, um überschüssiges Chlorgas sicher zu entfernen.
Wird der Hahn des Tropftrichters geöffnet, tropft Salzsäure auf das Kaliumpermanganat und es entsteht Chlorgas. In der Gaswaschflasche kann sofort ein rotes Aufleuchten beobachtet werden (Raum abdunkeln).
Entsorgung
Sämtliche Schliffverbindungen werden geöffnet und die Apparatur über Nacht im Abzug zum Ablüften gelassen. Die Gasentwicklerlösung kommt in den Behälter für anorganische Schwermetallabfälle, der Inhalt der Gaswaschflasche wird mit Salzsäure neutralisiert und verdünnt dem Abwasser zugeführt.
Erklärung
Chlor reagiert mit der Natronlauge unter Disproportionierung zu Hypochlorit und Chlorid. Das Hypochlorit wird dann vom Wasserstoffperoxid zum Chlorit oxidiert, welches rasch unter Entwicklung von Singulett-Sauerstoff zerfällt:
H2O2 + OCl- -> ClOO- + H2O
ClOO- -> 1O2 + Cl-
Doch was ist nun Singulett-Sauerstoff überhaupt? Dazu müssen wir uns das Molekülorbitaldiagramm von Sauerstoff ansehen. Im Grundzustand – dem Triplett-Sauerstoff – sind die Spins der Elektronen in den π* Orbitalen gemäß der Hund’schen Regel parallel ausgerichtet, beim Singulett-Sauerstoff antiparallel.
Der Singulett-Sauerstoff ist daher energiereicher und instabil. Bei der Umwandlung zum Grundzustand wird Energie in Form von rotem Licht abgegeben.
Foto
Video
Literatur
Mortimer, C. E.: Chemie – Das Basiswissen der Chemie. 13., korrigierte Auflage. Stuttgart, New York: Georg Thieme Verlag. 2019.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Flammenfärbung
Von Robert Wilhelm Bunsen (dem Entwickler des Bunsenbrenners) erzählt man sich folgende Geschichte:
Als er mit einem Freund in einem Restaurant essen ging, gab es Hähnchen. Sobald sie fertig waren, zückte er aus der Manteltasche ein Fläschchen und streute Lithiumchlorid über die eben abgenagten Knochen. Am nächsten Tag gingen sie wieder dorthin - es gab Hühnersuppe. Er tauchte einen Platindraht in die Suppe und hielt diesen in die Flamme eines Spiritusbrenners. Diese verfärbte sich rot, wodurch er nachgewiesen hatte, dass die abgenagten Knochen des Vortages für die Suppe verwendet wurden!
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Von Robert Wilhelm Bunsen (dem Entwickler des Bunsenbrenners) erzählt man sich folgende Geschichte:
Als er mit einem Freund in einem Restaurant essen ging, gab es Hähnchen. Sobald sie fertig waren, zückte er aus der Manteltasche ein Fläschchen und streute Lithiumchlorid über die eben abgenagten Knochen. Am nächsten Tag gingen sie wieder dorthin - es gab Hühnersuppe. Er tauchte einen Platindraht in die Suppe und hielt diesen in die Flamme eines Spiritusbrenners. Diese verfärbte sich rot, wodurch er nachgewiesen hatte, dass die abgenagten Knochen des Vortages für die Suppe verwendet wurden!
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Bunsenbrenner, Magnesiastäbchen, Feuerzeug, 2x 50 mL Becherglas, 5-6 Uhrglasschälchen, Spatel.
Chemikalien
verd. 10% Salzsäure
Natriumchlorid
Kaliumchlorid
Lithiumchlorid
Calciumchlorid
Bariumchlorid
Kupfersulfat
Durchführung
In jedes der Uhrgläser kommt ein Spatel des entsprechenden Salzes. Ein Magnesiastäbchen, welches zuvor ausgeglüht wurde, wird in dest. Wasser getaucht und damit eine kleine Menge eines beliebigen Salzes aufgenommen und in die nicht leuchtende Brennerflamme gehalten.
Danach reinigt man das Stäbchen durch Eintauchen in Wasser, dann Salzsäure, dann erneut Wasser, bevor ein anderes Salz getestet wird.
Anmerkung
Die Magnesiastäbchen sollten nur an einem Ende angefasst werden. Natriumionen durch Schweiß auf der Haut, sorgen für eine schwer zu entfernende, alles überdeckende, gelbe Flamme. Das anfängliche Ausglühen würde sich dadurch auf mehrere Minuten erstrecken.
Substituiert man giftiges Bariumchlorid mit verträglicherem Kupfersulfat, ist der Versuch als Schülerversuch durchführbar.
Entsorgung
Kupfersulfat und Bariumchlorid (sowie alle Waschlösungen bei Verwendung dieser beiden Stoffe), kommen in den Behälter für anorganische Schwermetallsalze.
Die übrigen Salze werden gut verdünnt über den Ausguss entsorgt. Nicht kontaminierte Salzsäure wird vorhergehend mit Natriumcarbonat neutralisiert (starke Gasentwicklung!).
Erklärung
Zur Erklärung kann man das Bohr'sche Atommodell heranziehen (wobei streng genommen nur das Wasserstoffspektrum damit erklärt werden kann): Demnach kreisen die Elektronen auf definierten Bahnen um den Atomkern.
Wenn wir Energie in Form von Wärme hinzufügen, gehen die Elektronen in einen angeregten Zustand über und wechseln in eine äußere Schale. Beim zurückspringen in den Grundzustand, wird diese Energie wieder in Form von Licht frei, wobei die Wellenlänge (und dadurch die Farbe) vom Energiebetrag und dadurch von der Differenz der Energien des höheren und des niedrigeren Energiezustands abhängt.
Betrachtet man dieses Licht durch ein Spektrometer, werden die einzelnen Spektrallinien sichtbar. Diese, sowie deren Verteilung, ist für jedes Element charakteristisch und dient als Nachweismethode. Die Existenz von Indium wurde erstmalig durch die indigoblaue Spektrallinie nachgewiesen (nach der das Element auch benannt wurde).
Die Spektrallienen der meisten Elemente liegen allerdings nicht im sichtbaren Bereich des Lichts: Magnesium emittiert unter anderem im UV-Bereich. Daher können wir beim dem Versuch Stäbchen aus Magnesiumoxid verwenden, ohne dass eine störende Färbung auftritt. Außerdem ist das Emittieren von UV Licht ein Grund, warum man nicht direkt in ein Magnesiumfeuer schauen soll.
Fotos
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Kaliumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.


![IMG_9246[1].JPG](https://images.squarespace-cdn.com/content/v1/5e84c5e50f51f66db8a975b0/1615796116481-N2JKJ26TRZ8A1PFJTULL/IMG_9246%5B1%5D.JPG)