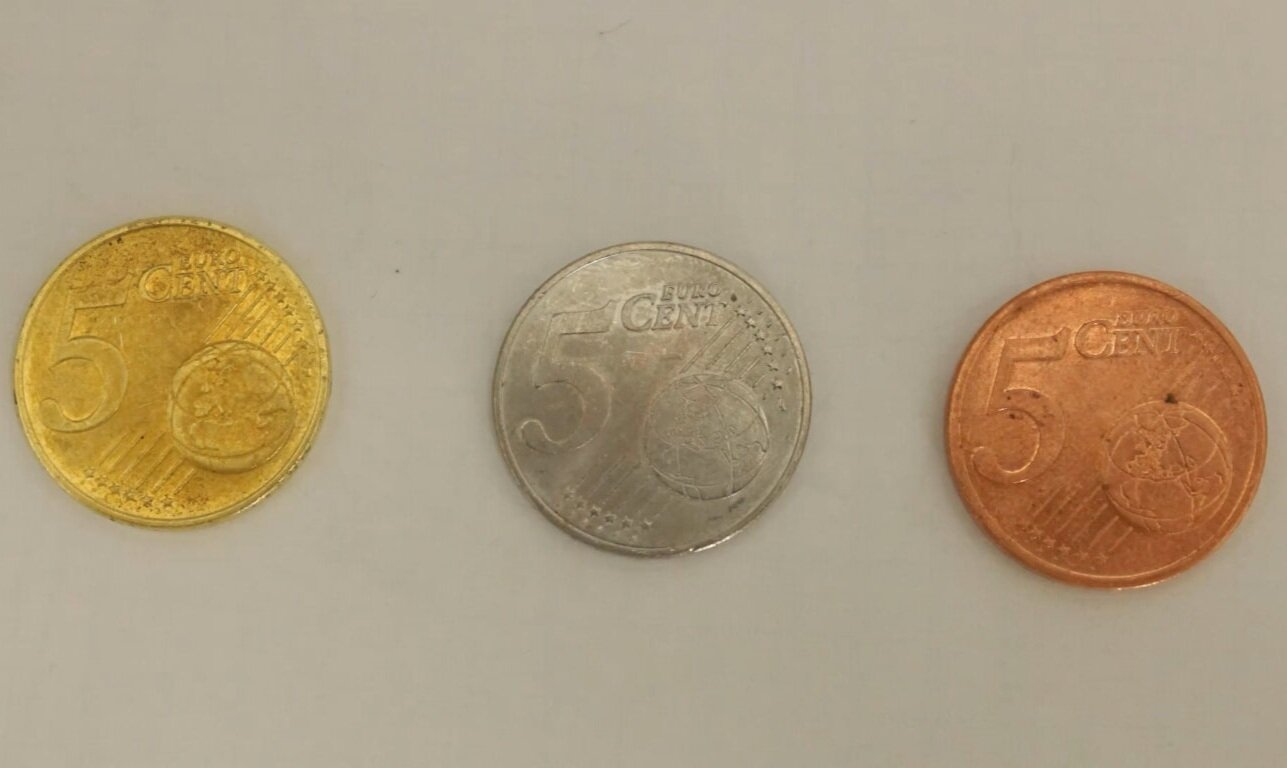Hölle des Gummibärchens
Bei diesem eindrucksvollen Versuch handelt es sich um ein Demonstrationsexperiment zu Redox-Reaktionen. Ein Gummibärchen wird in geschmolzenes Kaliumchlorat gegeben - es kommt zu einer heftigen Flammenbildung unter Rauch- und Geräuschentwicklung.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bei diesem eindrucksvollen Versuch handelt es sich um ein Demonstrationsexperiment zu Redox-Reaktionen. Ein Gummibärchen wird in geschmolzenes Kaliumchlorat gegeben - es kommt zu einer heftigen Flammenbildung unter Rauch- und Geräuschentwicklung.
Schwierigkeitsgrad
Demonstrationsexperiment – mittel
Geräte
Reagenzglas, Stativ, Bunsenbrenner, Gummibärchen, Pinzette
Chemikalien
Kaliumchlorat
Hinweis
Kaliumchlorat kann mit Reduktionsmitteln explosiv reagieren. Unter dem Reagenzglas ist eine feuerfeste Unterlage zu platzieren.
Durchführung
Ein schräg im Stativ eingespanntes Reagenzglas wird mit 3 Spateln reinem Kaliumchlorat befüllt und dieses anschließend mit dem Bunsenbrenner unter größter Vorsicht geschmolzen. Nun wird mit Hilfe der Pinzette ein Gummibärchen in das Reagenzglas gegeben. Das Gummibrächen verbrennt in einer mehrere Sekunden dauernden Reaktion beinahe vollständig.
Entsorgung
Die Reste sind im Feststoffabfall zu entsorgen.
Erklärung
Der im Zucker des Gummibärchen enthaltene Kohlenstoff wird in einer heftigen exothermen Reaktion zu Kohlenstoffdioxid oxidiert.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Verbrennungsreaktionen in flüssigem Sauerstoff
Flüssiger Sauerstoff ist ein außerordentlich starkes Oxidationsmittel. Das liegt hauptsächlich daran, dass kondensierte Materie viel dichter vorliegt. Dadurch Verbrennungen sehr schnell ab, sodass er auch Einzug als Oxidans bei Raketentreibstoffen fand.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Flüssiger Sauerstoff ist ein außerordentlich starkes Oxidationsmittel. Das liegt hauptsächlich daran, dass kondensierte Materie viel dichter vorliegt. Ein Mol gasförmiger Sauerstoff nimmt ein Volumen von ungefähr 22 L ein. Normale Luft besteht zu ca. 80 % aus Stickstoff und nur zu ca. 20 % aus Sauerstoff – ein Mol davon kommt also nur in mehr als 100 L Luft vor. Die Geschwindigkeit einer Verbrennungsreaktion wird so durch die Verfügbarkeit von Sauerstoff limitiert. Wird Sauerstoff kondensiert, nimmt ein Mol nur noch ein Volumen von 26 mL ein. Obwohl Flüssigsauerstoff mit einem Siedepunkt von -183 °C äußerst kalt ist, laufen dadurch Verbrennungen sehr schnell ab, sodass er auch Einzug als Oxidans bei Raketentreibstoffen fand.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
Dewargefäß, Reagenzglas, Sauerstoff-Druckgasflasche, Edelstahltiegel, Feuerzeug, Feuerlöscher, Cryo-Handschuhe, Pinzette, Zigarre, Schraubenzieher, Stativmaterial
Chemikalien
Flüssiger Stickstoff
Durchführung
Um Flüssigsauerstoff herzustellen, wird ein Dewargefäß mit Flüssigstickstoff befüllt und damit ein Reagenzglas gekühlt. Aus einer Sauerstoff-Druckgasflasche wird mittels Druckminderer ein sehr schwacher Sauerstoffstrom eingestellt und über eine Pasteurpipette in das gekühlte Reagenzglas eingeleitet. Da Stickstoff einen etwas tieferen Siedepunkt als Sauerstoff aufweist, vermag er letzteren zu kondensieren. In 10 min lassen sich in etwa 15 mL Flüssigsauerstoff herstellen.
Für die Versuche wird das Reagenzglas aus dem Dewargefäß entfernt. Sofort fällt die blassblaue Farbe des Sauerstoffs auf. Dies liegt an in kondensierter Form ebenfalls häufiger vorliegendem Singulett-Sauerstoff (ein Experiment dazu gibt es hier).
Brennendes Streichholz
Wird nun ein brennendes Streichholz in das Reagenzglas geworfen (Pinzette, Abstand!), verbrennt dieses nahezu rückstandslos.
Schnelles Zigarrenrauchen
Eine Zigarre wird an einem Schraubenzieher aufgespießt und für mehrere Minuten in flüssigem Sauerstoff getränkt. Danach wird der Schraubenzieher in einer Stativklemme eingespannt und die Zigarre am anderen Ende entzündet. Diese verbrennt in wenigen Sekunden.
Müsli mit Sauerstoff
Auf Lebensmittelverpackungen findet sich eine Angabe des sogenannten Brennwerts in kcal oder kJ. 100 g „Kellog’s Smacks“ haben z.B. einen Brennwert von 1578 kJ. Um das in Relation zu setzen: Die Reaktion von Wasserstoff mit Sauerstoff (Hier haben wir das Experiment beschrieben) liefert pro Mol „nur“ 571 kJ (Anmerkung: Die molare Masse von Wasserstoff ist 1 g/mol. 100 g würden also eine Energie von 57 100 kJ freisetzen). Diesen dennoch beachtlichen Energiegehalt kann man folgendermaßen darstellen:
Ein paar wenige Körner werden in einem Edelstahltiegel platziert und - anstatt von Milch -mit genug Flüssigsauerstoff übergossen und nach etwas Einwirkzeit entzündet.
Die 1578 kJ/100 g beziehen sich auf den vom Körper verwertbaren Brennwert. In dem Experiment wird das Müsli aber komplett verbrannt, wodurch ein höher Brennwert vorgetäuscht wird. Der Körper kann nicht 100 % der Energie verwerten – darum ist der Brennwert auf der Verpackung etwas geringer angegeben.
Verbrennung von Eisenwolle
In einem Edelstahltiegel wird etwas Flüssigsauerstoff bereitgestellt und eine nicht zu große Menge brennende Eisenwolle hinzugefügt. Die Verbrennung erreicht Temperaturen der Thermit-Mischung und brennt ein Loch in den Tiegel.
Entsorgung
Übrig gebliebene Reste an Flüssigstickstoff können in warmen Wasser vollständig sublimiert werden. Dabei entsteht wie bei Trockeneis viel Nebel. Abzug!
Foto
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Experimente mit Flüssigstickstoff
Flüssiger Stickstoff besitzt eine Temperatur von -196 °C. Viele Experimente damit sind Klassiker bei Chemie- oder Physikshows. Wir haben die Besten probiert und auf folgender Seite zusammengestellt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Flüssiger Stickstoff besitzt eine Temperatur von -196 °C. Viele Experimente damit sind Klassiker bei Chemie- oder Physikshows. Wir haben die Besten auf folgender Seite zusammengestellt.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Dewargefäß, Luftballon, Banane, Rose, Pinzette, Hammer, Cryo-Handschuhe
Chemikalien
Flüssiger Stickstoff
Durchführung
Leidenfrost-Effekt:
Der flüssige Stickstoff wird direkt über die eigene Hand gegossen.
Aufgrund des Leidenfrost-Effekts bildet sich beim Kontakt zwischen Flüssigstickstoff und der Hand eine gasförmige Schutzschicht und es kommt zu keinen schwerwiegenden Erfrierungen.
Achtung: Der Leidenfrost Effekt besteht nur für kurze Zeit. Längerer Kontakt mit Flüssigstickstoff führt zwangsläufig zu Erfrierungen.
Luftballon:
Ein mit Luft befüllter und anschließend verknoteter Ballon wird in Flüssigstickstoff getaucht.
Durch die Abkühlung verliert der Ballon zuerst an Volumen. Wird er wieder aus dem Flüssigstickstoff herausgenommen, erwärmt sich der Ballon an der Umgebungsluft und erlangt seine ursprüngliche Größe.
Gefrorene Banane:
Eine Banane wird in Flüssigstickstoff getaucht und anschließend wird mit einem Hammer darauf geschlagen.
Wegen der niedrigen Temperatur des flüssigen Stickstoffs gefriert das Wasser in Banane sehr rasch und verwandelt das sonst weiche Fruchtfleisch in hartes, sprödes Eis.
Gläserne Rose:
Eine Rose wird in Flüssigstickstoff getaucht. Anschließend lassen sich mit leichten Handberührungen die Blütenblätter brechen.
Auch in den Rosenblättern gefriert das Wasser, wodurch diese hart und spröde werden.
Entsorgung
Übrig gebliebene Reste an flüssigem Stickstoff können in warmem Wasser vollständig sublimiert werden. Dabei entsteht wie bei Trockeneis viel Nebel. Abzug!
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Die Schlange des Pharao
Ursprünglich basierte dieses Experiment auf Quecksilber(II)-thiocyanat. Nachdem dieses aber wegen seiner Giftigkeit und der beim Verbrennen entstehenden Quecksilberdämpfe nicht mehr dafür verwendet werden sollte, wird hier eine - zumindest von den Ausgangschemikalien her - unbedenklichere Variante vorgestellt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Ursprünglich basierte dieses Experiment auf Quecksilber(II)-thiocyanat. Nachdem dieses aber wegen seiner Giftigkeit und der beim Verbrennen entstehenden Quecksilberdämpfe nicht mehr dafür verwendet werden sollte, wird hier eine - zumindest von den Ausgangschemikalien her - unbedenklichere Variante vorgestellt.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Mörser, Metallschale/Abdampfschale, Sand, Spritzflasche, Spatel/Löffel, Feuerzeug
Chemikalien
Backpulver
Staubzucker (Puderzucker)
Ethanol
Hinweis
Durchführung
In einem Möser werden 5 g Backpulver mit 20 g Staubzucker vermischt. In eine Metallschale wird so viel Sand eingefüllt, dass sich ein kleiner Hügel in der Mitte bildet.
Nun wird die Erhöhung aus Sand mit reichlich Ethanol aus der Spritzflasche gut befeuchtet und anschließend am höchsten Punkt mit einem Spatel eine kleine Vertiefung gemacht. In diese wird das Backpulver-Staubzucker-Gemisch gegeben und dann der Ethanol entzündet.
Es bildet ein Kohlenstoffgerüst, das langsam aus dem Sand herauswächst. Die Reaktion ist nach ca. 15 min beendet.
Entsorgung
Die Kohlenstoffschlangen können nach dem Abkühlen im Hausmüll entsorgt werden.
Erklärung
Das im Backpulver enthaltene Salz Natriumhydrogencarbonat, welches beim Backen für das Aufgehen der Gebäcke sorgt, zerfällt bei Temperaturen über 65°C. Dabei wird unter anderem das Gas Kohlenstoffdioxid und Wasser(-dampf) freigesetzt.
Ein Teil des (Staub-)Zuckers verbrennt, wobei wiederum CO2 und Wasser entstehen.
Der restliche Teil des Zuckers verbrennt unvollständig und lässt elementaren, schwarzen Kohlenstoff zurück.
Die Gase CO2 und H2O drücken das entstehende Kohlenstoffgerüst immer weiter nach oben, so dass dieses in Form einer schwarzen „Schlange“ aus der Masse aufsteigt.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Backpulver (Kein gefährlicher Stoff nach GHS)
Zucker (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Brennender Schaum - Brennende Hand
In diesem eindrucksvollen Experiment, welches einem Zaubertrick nahe kommt, werden Butanblasen in der Hand entzündet und eine Flamme kann für mehrere Sekunden in der Hand gehalten werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
In diesem eindrucksvollen Experiment werden Butanblasen in der Hand entzündet, wobei die Flamme für mehrere Sekunden auf der Hand gehalten werden kann.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Schüssel, Feuerzeug
Chemikalien
Spülmittel
Feuerzeuggasflasche (Butangas)
Durchführung
Die Schüssel wird zu 2/3 mit lauwarmen Wasser gefüllt und einige Spritzer Spülmittel hinzugegeben. Mit der von Uhren, Armbändern (o.Ä.) befreiten Hand wird das Spülmittel verrührt und anschließend bis zum Ellbogen benässt.
Anschließend wird die Feuerzeuggasflasche auf den Boden der Schüssel gedrückt - es entsteht ein Schaum auf der Wasseroberfläche. Diese Schaumblasen werden auf die Hand genommen und am besten von einem Assistenten entzündet.
Anmerkung
Es ist darauf zu achten, dass der gesamte Arm bis zum Ellbogen befeuchtet ist und alles Brennbare (auch die Schüssel mit dem restlichen Schaum!) vor dem Entzünden außer Reichweite gebracht wird. Es empfiehlt sich geeignete Löschmöglichkeiten parat zu haben.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Hydrophobe Bärlappsporen
Wenn man die Hand ins Wasser hält, wird sie nass - das weiß jedes Kind. Streut man aber Bärlappsporen zuvor auf die Wasseroberfläche kann man die Hände ins Wasser stecken und sogar einen Gegenstand aufheben ohne nass zu werden!
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Wenn man die Hand ins Wasser hält, wird sie nass - das weiß jedes Kind. Streut man aber Bärlappsporen zuvor auf die Wasseroberfläche kann man die Hände ins Wasser stecken und sogar einen Gegenstand aufheben ohne nass zu werden!
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
Glasaquarium/-schüssel, kleiner Gegenstand
Chemikalien
Bärlappsporen (Lycopodium)
Durchführung
Der Gegenstand wird am Boden des Glasaquariums platziert und dieses dann mit Wasser gefüllt. Die Bärlappsporen werden auf das Wasser gestreut, sodass die gesamte Wasseroberfläche mit diesen bedeckt ist. Für eine Fläche mit der Größe von 20x30 cm braucht man ca. 100 mL. Dann kann mit der Hand hineingegriffen und der Gegenstand herausgeholt werden.
Entsorgung
Bärlappsporen können im Hausmüll entsorgt werden.
Erklärung
Bärlappsporen sind der Samenstaub von Farngewächsen. Wenn die Hand ins Wasser eingetaucht wird bildet sich ein dünner Film an der Haut, der durch die Adhäsionskräfte zwischen den Teilchen verbunden bleibt. Da die Sporen äußerst hydrophob - also wasserabstoßend - sind, bildet sich somit eine Art “Handschuh” der die Hand vor der Nässe des Wassers schützt.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Landolt-Reaktion - Cola Zeitversuch
Chemische Reaktionen können ablaufen, ohne dass sofort eine Veränderungsichtbar ist. Ein sehr gutes Beispiel dafür ist die Landolt-Reaktion oder auch bekannt unter dem Landolt’schen Zeitversuch. Hierbei werden zwei farblose Flüssigkeiten vermischt, die zuerst farblos bleiben und erst nach einer bestimmten Zeit schlagartig dunkelblau/schwarz werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Chemische Reaktionen können ablaufen, ohne dass sofort eine Veränderung sichtbar ist. Ein sehr gutes Beispiel dafür ist die Landolt-Reaktion oder auch bekannt unter dem Landolt’schen Zeitversuch. Hierbei werden zwei farblose Flüssigkeiten vermischt, die zuerst farblos bleiben und erst nach einer bestimmten Zeit schlagartig dunkelblau/schwarz werden.
Schwierigkeitsgrad
Demonstrationsexperiment- mittel
Geräte
3 Bechergläser 250mL, 3 Glasrührstäbe, Colaflasche 500mL
Chemikalien
Stärke
konz. Schwefelsäure
Ethanol
Natriumsulfit
Kaliumiodat
Durchführung
Herstellung der benötigten Lösungen
Lösung A: 0,62 g Stärke in 300 mL Wasser in der Siedehitze lösen und auf Raumtemperatur (!) abkühlen lassen.
Lösung B: 0,116 g Natriumsulfit gemeinsam mit 0,4 g konz. Schwefelsäure in 98,6 mL Wasser lösen und 1 mL Ethanol hinzugeben.
Lösung C: 0,43 g Kaliumiodat in 99,56 mL Wasser lösen.
Landolt-Reaktion - Cola-Zeitversuch:
Lösung A und B werden in die Cola-Flasche vorgelegt und durch Schütteln vermischt. Nun wird zügig Lösung C hinzugegeben, die Flasche fest verschlossen, kräftig geschüttelt und auf einem Tisch oä. platziert. Der Farbumschlag passiert je nach Temperatur zwischen 15-20 Sekunden.
Anmerkung
Genaues Arbeiten ist obligat, ansonsten tritt der Farbumschlag zu schnell, nicht scharf oder eventuell gar nicht ein.
Entsorgung
Die “Cola” wird mit Ascorbinsäure versetzt um das Iod zu reduzieren (Lösung muss farblos werden!), dann kann die Lösung im Ausguss entsorgt werden.
Erklärung
Die Reaktionsgleichung des Gesamtvorgangs ist die folgende:
Die Redoxreaktion läuft jedoch in mehreren Teilreaktionen mit unterschiedlichen Reaktionsgeschwindigkeiten ab die zur zeitverzögerten Dunkelblau-/Schwarzfärbung führen.
Iodat und Sulfit bilden in einer Redoxreaktion Iodid-Ionen:
IO3- + 3 SO32- → I- + 3 SO42- Iodid und Iodat reagieren in einer Komproportionierung zu Iod:
IO3− + 5I− + 6H+ ⟶ 3I2 + 3H2O Das jedoch sofort wieder zu Iodid reduziert wird, solange in der Lösung noch Sulfit vorliegt:
SO32− + I2 + H2O ⟶ 2I− + SO42− + 2H+ Erst wenn das gesamte Sufit durch die Reaktionen 1 und 3 aufgebraucht wurde, kommt es zur Bildung einer nachweisbaren Menge Iod welches mit überschüssigem Iodid Polyiodid bildet, das mit Stärke zum schnellen Farbumschlag führt:
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Stärke (Kein gefährlicher Stoff nach GHS)
Natriumsulfit (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
"Versilbern/-golden" einer Kupfermünze
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Schwierigkeitsgrad
Schülerversuch - mittel
Geräte
Becherglas, Tiegelzange, Magnetrührer, Magnetrührstäbchen, Kupfermünzen, Bunsenbrenner, Thermometer
Chemikalien
Kaliumhydroxid
Zinkpulver
Ethanol
Durchführung
Eine Kupfermünze wird in ein kleines Becherglas mit 100 mL 10 %iger Kalillauge (hergestellt aus 10 g Kaliumhydroxid und 90 mL Wasser) und 6 g Zinkpulver gegeben. Die Kalilauge sollte dabei eine Temperatur von 80 °C aufweisen. Nach 2-3 Minuten (wobei längere Einwirkzeiten das Ergebnis verbessern) hat eine Zinkschicht die gesamte Kupfermünze bedeckt. Diese wird mit einer Tiegelzange herausgenommen und durch Putzen mit Küchenrolle von überschüssigem Zink und Wasser befreit. Anschließend wird die Münze so lange in der Brennerflamme erwärmt, bis sie vollständig „vergoldet“ erscheint.
Entsorgung
Die überschüssige Lösung im Sammelbehälter für giftige anorganische Rückstände sowie Schwermetall-Salze und ihre Lösungen entsorgen.
Hinweis
Vor dem Versuch unbedingt die Kupfermünzen gut mit Spülmittel oder Ethanol reinigen und nur mit Handschuhen berühren!
Erklärung
Das Zinkpulver ist an der Oberfläche mit einer festen Zinkoxid- (ZnO) Schicht überzogen und somit passiviert. Dieses ZnO geht im basischen Milieu als Tetrahydroxozinkat in Lösung und scheidet sich an der Kupfermünze ab. Das steht im Widerspruch mit den Standardpotentialen, weil sich ein unedleres Metall (Zink) am edleren Metall (Kupfer) abscheidet. Tetrahydroxozinkat als Komplex hat aber ein anderes Standardpotential als Zink, weshalb Kupfer „unedler“ als der Komplex ist und die Reaktion abläuft.
Durch das Erhitzen der Münzen im Bunsenbrenner wird die Bildung einer Legierung zwischen den zwei Metallen – Messing - beschleunigt. Es kommt zu einem typischen Metallgitter aus verschiedenen Metallionen (Zn und Cu) und freibeweglichen Elektronen.
Foto
Video
Quelle
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Brennender Geldschein
Dieses eindrucksvolle Show-Experiment bleibt sicher jedem Publikum für einige Zeit in Erinnerung. Ein (echter!) Geldschein wird vor ihren Augen angezündet - verbrennt jedoch nicht.
Das Experiment kann hervorragend dafür verwendet werden um eine - verhältnismäßig - “kalte” Verbrennung zu demonstrieren. Zudem vermittelt das Entzünden eines wertvollen Scheins die 100%ige Sicherheit des Vorführenden, mit der die Experimente idealerweise vorbereitet vorgeführt werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Dieses eindrucksvolle Show-Experiment bleibt sicher jedem Publikum für einige Zeit in Erinnerung. Ein (echter!) Geldschein wird vor ihren Augen angezündet - verbrennt jedoch nicht.
Das Experiment kann hervorragend dafür verwendet werden um eine - verhältnismäßig - “kalte” Verbrennung zu demonstrieren. Zudem vermittelt das Entzünden eines wertvollen Scheins die 100%ige Sicherheit des Vorführenden, mit der die Experimente idealerweise vorbereitet vorgeführt werden.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
250 ml Becherglas, feuerfeste Zange oder Pinzette, Geldschein (beliebiger Wert), Kristallisierschale, Bunsenbrenner
Chemikalien
96% Ethanol (Brennspiritus)
Natriumchlorid (Kochsalz)
Durchführung
In dem Becherglas wird Ethanol im Verhältnis 1:1 mit dest. Wasser gemischt. Dazu kommt ein Löffel Natriumchlorid, wobei die Flüssigkeit in eine Kristallisierschale vom unlöslichen Rückstand dekantiert wird.
Mithilfe der Pinzette wird der Geldschein mit der Ethanol-Wasser-Mischung getränkt und dann am unteren Ende (z.B. mit einem Bunsenbrenner) angezündet.
Im (abgedunkelten!) Raum ist, sobald der Schein entzündet wird, eine gelb-orange Flamme zu erkennen, die sich bis zum oberen Ende des Geldscheins bewegt und kurz darauf erlischt.
Anmerkung
Entsorgung
Ethanol-Wasser-Mischung sowie reines Kochsalz kann im Ausguss entsorgt werden.
Erklärung
Flammen bestehen aus brennenden Gasen. Beim hier verwendeten Ethanol-Wasser-Gemisch verdampft der Ethanol und entzündet sich.
Die bei der Verbrennung entstehende Wärme verdampft weiteren Ethanol und erhält somit die Verbrennung. Gleichzeitig entsteht aber auch Wasser, welches auf Grund seiner hohen Wärmekapazität und Verdampfungsenthalpie jedoch kaum verdampft und dafür sorgt, dass die Temperatur nicht die für die Entzündung von Cellulose nötigen 170°C erreicht.
Das Gemisch verarmt mit der Zeit immer mehr an Ethanol, bis die Konzentration von Ethanol in der Gasphase unter 3,5% sinkt. Die ist die untere Grenze für die Entzündbarkeit von Ethanol, wodurch die Flamme ausgeht.
Das im Natriumchlorid enthaltene Natrium sorgt für die gelb-orange Färbung, da Ethanol normalerweise mit einer nur schwer sichtbaren bläulichen Flamme verbrennt.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Verbrennung von Borsäuretrimethylester
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die grüne Flammenfärbung des Esters kann analytisch als Indiz für die Anwesenheit von Borsäure bzw. Boraten dienen. Dieser Nachweis ist sogar so empfindlich, dass er durch Spuren von Borsäure (z.B. aus den in Laboren verwendeten Borosilikatgläsern) ausschlägt. Wir zeigen den Versuch gerne als Demonstrationsexperiment einer grünen Flammenfarbe.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Feuerfeste Unterlage, Metallschale, 800 mL Becherglas, Spatel, Feuerzeug
Chemikalien
konz. 96% Schwefelsäure
Methanol
Borsäure
Hinweise
Ausführung im Abzug! Borsäure und entstehendes Bortrioxid sind reproduktionstoxisch!
Durchführung
In die Metallschale wird ein Spatel Borsäure gegeben und mit 15 mL Methanol aufgefüllt. Nun werden noch ca. 10 Tropfen konz. Schwefelsäure hinzugegeben und mit einem Spatel umgerührt.
Die Lösung wird mit dem Feuerzeug entzündet – es kommt zu einer grünen Flammenfarbe. Um die Reaktion zu beenden wird die Schale mit dem Becherglas abgedeckt und die Flamme dadurch erstickt.
Entsorgung
Die Lösung wird in den Sammelbehälter für halogenfreie organische Lösemittel gegeben.
Erklärung
Borsäure reagiert in Gegenwart von konzentrierter Schwefelsäure mit Methanol zum Borsäuretrimethylester. Die Reaktion (Veresterung) wird durch die wasserentziehende und katalytische Wirkung der konz. Schwefelsäure begünstigt.
Borsäuretrimethylester ist leicht flüchtig und lässt sich beim Entzünden des überschüssigen Methanols über die grüne Flamme identifizieren.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Wasserstoffexplosion
Wasserstoff, das erste Element im Periodensystem, ist ca. 14 Mal leichter als Luft, bildet jedoch mit dieser explosionsfähige Gemische.
Auch wenn reine Wasserstoffballone eher verbrennen und nicht wie Gemische mit Luftsauerstoff explodieren oder gar analog zum Chlorknallgallgas schon bei Lichteinstrahlung detonieren, ist dieses Experiment doch sehr eindrucksvoll.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Wasserstoff, das erste Element im Periodensystem und ist ca. 14-mal leichter als Luft. In Verbindung mit letzterer bildet Wasserstoff sogar explosionsfähige Gemische.
Auch wenn reine Wasserstoffballone eher verbrennen und nicht wie Gemische mit Luftsauerstoff explodieren oder gar analog zum Chlorknallgas schon bei Lichteinstrahlung detonieren, ist dieses Experiment doch sehr eindrucksvoll.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Stativ, Doppelmuffe, Klemme, Luftballon, Fernzünder/Stab mit Kerze
Chemikalien
Wasserstoff
Hinweise
Bei Zündung unbedingt größeren Abstand halten und Mund öffnen. Nicht im Abzug durchführen.
Durchführung
Ein Luftballon wird mit Wasserstoff gefüllt, verknotet und am oberen Ende eines Stativs befestigt. Nun wird der Ballon aus sicherer Entfernung mittels Fernzündung oder eines Langen Stabs gezündet.
Entsorgung
Im Hausmüll
Erklärung
Der Wasserstoff setzt sich gemeinsam mit dem Sauerstoff aus der Luft in einer stark exothermen Reaktion zu Wasser um.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Fettexplosion
Fettbrände sind eine reale Gefahr in jeder Küche. Eigentlich sollte daher jeder Schüler die Möglichkeit bekommen, das richtige Löschen zu üben. Von einem Fettbrand geht in der Regel keine Gefahr aus – außer, wenn falsch reagiert wird! Im Ernstfall verhindert Adrenalin rationales Denken, die richtige Reaktion müsste also automatisiert werden. Leider besteht zu dieser Brandschutzübung meistens nicht genug Zeit - eine Demonstration muss hier wohl leider genügen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Fettbrände sind eine reale Gefahr in jeder Küche. Eigentlich sollte daher jeder Schüler die Möglichkeit bekommen, das richtige Löschen zu üben. Von einem Fettbrand geht in der Regel keine Gefahr aus – außer, wenn falsch reagiert wird! Im Ernstfall verhindert Adrenalin rationales Denken, die richtige Reaktion müsste also automatisiert werden. Leider besteht zu dieser Brandschutzübung meistens nicht genug Zeit - eine Demonstration muss hier wohl leider genügen.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Dreifuß, Tondreieck, Bunsenbrenner, Metallschälchen, Spritzflasche, Löschdecke, Speiseöl, Feuerzeug
Hinweise
CO2-Feuerlöscher und Löschdecke bereithalten.
Durchführung
Ein kleines Schälchen aus Metall (Glas oder Keramik darf wegen der Bruchgefahr nicht verwendet werden) wird mit < 10 mL (!) Öl befüllt und auf dem Dreifuß mit dem Brenner erhitzt. Das Öl beginnt weiß zu rauchen – diese Dämpfe werden mit dem Feuerzeug entzündet. Der Brenner wird entfernt und aus einigen Metern Abstand mit einer Spritzflasche, bis der Brand gelöscht ist, Wasser in das Feuer gespritzt.
Anmerkung
Manchmal geht der Brand nicht aus, es muss im Vorhinein für eine Möglichkeit gesorgt werden, in diesem Fall das Feuer richtig löschen zu können (z.B. durch eine Löschdecke).
Entsorgung
Kleine Reste Öl werden mit etwas Küchenrolle entfernt und diese im Restmüll entsorgt.
Erklärung
Das Öl heizt sich beim Verbrennen über 100°C – also dem Siedepunkt von Wasser – auf. Gelangt Wasser in das Feuer, verdampft es schlagartig und vergrößert sein Volumen um das Achtfache. Dabei wird viel Öl in die Luft geschleudert, dadurch kommt es mit mehr Sauerstoff in Kontakt, welcher die Verbrennung fördert.
Fotos
Video
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Natrium in Wasser
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann mit diesem Experiment unserer Reihe Alkalimetalle in Wasser das Verhalten von Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstriert werden.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer
Chemikalien
Natrium
0,1% Phenolphthalein-Lsg. (ethanolisch)
Durchführung
Die Wanne wird zu dreiviertel Wasser gefüllt und ein Filterpapier in die Mitte der Wanne auf die Wasseroberfläche gelegt. Nun wird das ca. erbsengroße Stück Natrium – welches vorher mit dem Messer entkrustet und mit Küchenrolle von der Schutzflüssigkeit befreit wurde - vorsichtig auf das Filterpapier gelegt. Nach einer kurzen Induktionsperiode brennt das Natrium ab und explodiert am Ende.
Das Wasser wird nach der Reaktion mit ein paar Tropfen Phenolphthalein-Lösung versetzt – ein Farbumschlag ist zu beobachten.
Anmerkung
Der Versuch muss unbedingt abseits von brennbaren Gegenständen durchgeführt werden!
Entsorgung
Die Natronlauge wird neutralisiert und kann im Abguss entsorgt werden.
Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Natriumstückchen zu entfernen.
Größere Mengen Natrium werden zuerst mit Isopropanol und dann vorsichtig mit Wasser versetzt. Die Lösung kommt neutral in den Ausguss.
Erklärung
Wenn Alkalimetalle wie Natrium mit Wasser in Kontakt kommen, läuft eine heftige exotherme Reaktion unter Wasserstofffreisetzung ab.
Durch das Filterpapier wird das Natrium am gleichen Ort fixiert. Der entstehende Wasserstoff verdünnt sich daher nicht, erreicht die untere Explosionsgrenze und entzündet sich.
Das entstandene Natriumhydroxid löst sich im Wasser und bildet so eine schwache Natronlauge, darum färbt sich Phenolphthalein violett.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank und Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemolumineszenz von Luminol
Chemolumineszenz beschreibt das Phänomen, wenn die Energie, die bei einer Reaktion freigesetzt wird, nicht – wie sonst üblich – als Wärme, sondern in Form von Licht abgegeben wird. Am weitesten verbreitet ist die Peroxyoxalat-Reaktion: In kommerziell erhältlichen Knicklichtern wird ein Oxalsäureester mit einem Fluoreszenzfarbstoff und Wasserstoffperoxid zum Leuchten „angeregt“.
Auch die Luminol-Reaktion findet Anwendung: Es werden nämlich Eisen-Ionen für die Chemolumineszenz benötigt. Dadurch lassen sich in der Forensik geringste Mengen Blut nachweisen, die weder mit freiem Auge noch unter UV-Licht sichtbar wären.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
EINLEITUNG
Chemolumineszenz beschreibt das Phänomen, wenn die Energie, die bei einer Reaktion freigesetzt wird, nicht – wie sonst üblich – als Wärme, sondern in Form von Licht abgegeben wird. Am weitesten verbreitet ist die Peroxyoxalat-Reaktion: In kommerziell erhältlichen Knicklichtern wird ein Oxalsäureester mit einem Fluoreszenzfarbstoff und Wasserstoffperoxid zum Leuchten „angeregt“.
Auch die Luminol-Reaktion findet Anwendung: Es werden nämlich Eisen-Ionen für die Chemolumineszenz benötigt. Dadurch lassen sich in der Forensik geringste Mengen Blut nachweisen, die weder mit freiem Auge noch unter UV-Licht sichtbar wären.
SCHWIERIGKEITSGRAD
Demonstrationsexperiment - einfach
GERÄTE
2x 250 mL Becherglas, 1000 mL Erlenmeyerkolben, 25 mL Erlenmeyerkolben, 300 mm Schlangenkühler, 10 mL Messkolben, Magnetrührer, Rührfisch, Trichter, Stativ, Analysenwaage, Spatel, 2 mL Spritzen, Kanülen
CHEMIKALIEN
Luminol
Natriumhydroxid
30% Wasserstoffperoxid
Kaliumhexacyanoferrat (III)
Fluorescein
DURCHFÜHRUNG
In einen 10 mL Messkolben werden 1,0 g Natriumhydroxid eingewogen und mit dest. Wasser bis zur Eichmarke aufgefüllt.
In der Zwischenzeit wird ein Magnetrührer aufgebaut, auf dem sich ein 1000 mL Erlenmeyerkolben befindet. In ein Stativ wird ein Schlangenkühler so platziert, dass dessen unteres Ende in den Erlenmeyerkolben mündet und auf das obere Ende ein Trichter aufgesetzt.
Lösung I: Von dieser 10% Natriumhydroxid-Lösung werden nach dem Erkalten 1,25 mL in ein 250 mL Becherglas überführt, mit 98,75 mL Wasser verdünnt und darin 0,025 g Luminol gelöst.
Lösung II: 0,375 g Kaliumhexacyanoferrat (III) werden in 99,6 mL Wasser gelöst und 0,75 mL 30% Wasserstoffperoxid hinzugefügt.
Lösung III: Die übrige 10% Natronlauge (8,75 mL) wird mit ca. 200 mL dest. Wasser verdünnt und darin eine Spatelspitze Fluorescein gelöst.
Lösung III kommt dann in den Erlenmeyerkolben, während Lösung I + II langsam und gleichzeitig in den Trichter zusammengeschüttet werden. Sobald sich die Lösungen mischen, ist eine blaue Leuchterscheinung zu beobachten, während der Inhalt des Erlenmeyerkolbens allmählich beginnt grün zu leuchten (unbedingt Raum abdunkeln!).
ANMERKUNG
Es empfiehlt sich, das Wasserstoffperoxid und das Luminol zeitnah zum Experiment zu lösen, da diese Verbindungen gelöst nur eine begrenzte Lagerstabilität aufweisen.
Mit Rhodamin B ist eine violette, anstatt einer grünen Fluoreszenz zugänglich. Dies wurde aber nicht getestet.
ENTSORGUNG
Die Reaktionslösung wird mit einer Kochplatte auf rund 50 mL eingeengt und als anorganischer Schwermetallabfall entsorgt. Wird der Versuch öfters durchgeführt, kann die Reaktionslösung auch gesammelt werden und alles auf einmal eingeengt werden.
ERKLÄRUNG
Luminol wird durch das Natriumhydroxid zu einem Dianion deprotoniert und dieses mit Wasserstoffperoxid zum 3-Aminophthalat-Dianion unter Abgabe von Stickstoff oxidiert. Das Dianion ist dabei in einem angeregten Zustand und gibt beim Wechsel in den Grundzustand Energie in Form von Licht ab. Das Kaliumhexacyanoferrat dient als Katalysator und sorgt für eine höhere Intensität, verkürzt aber die Leuchtdauer. Der genaue Mechanismus der Oxidation ist noch unbekannt, es wird aber angenommen, dass die Oxidation durch ein Hyperoxidradikalion (O2-) ermöglicht wird – Kaliumhexacyanoferrat sollte die Freisetzung dieser Radikale aus dem Wasserstoffperoxid fördern.
FOTO
VIDEO
LITERATUR
GEFÄHRDUNGSBEURTEILUNG (GESTIS-STOFFDATENBANK, 2020)
Kaliumhexacyanoferrat III (Kein gefährlicher Stoff nach GHS)
Luminol (Kein gefährlicher Stoff nach GHS)
werbung
Kaliumpermanganat + Glycerin = Vulkanausbruch
Mit Zischen, Rauchen und violetten Flammen eruptiert unser chemischer Vulkan wenige Sekunden nach dem Mischen. Es gibt nur wenige Experimente, die so schön demonstrieren, welch ungeheure Energie bei manchen chemischen Reaktionen freiwerden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Mit Zischen, Rauchen und violetten Flammen eruptiert unser chemischer Vulkan wenige Sekunden nach dem Mischen.
Es gibt nur wenige Experimente, die so schön demonstrieren, welch ungeheure Energie bei manchen chemischen Reaktionen freiwerden kann. Es wird gezeigt, warum Oxidationsmittel getrennt von Reduktionsmitteln gelagert werden müssen und was passieren kann, wenn man unbedacht mit starken Oxidationsmitteln experimentiert.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Feuerfeste Unterlage (z.B. Blech auf einer Waschbetonplatte), 50 mL Becherglas, Waage, 5 mL Spritze, Spatel
Chemikalien
Kaliumpermanganat
Glycerin
Hinweise
- Ausführung im Abzug!
- Nicht mehr als die angegebenen Mengen verwenden!
- Sollte die Reaktion nicht spontan starten, darf der Reaktionsansatz nicht im Müll entsorgt werden! Ein verspätetes Entzünden würde einen Brand verursachen! Vor der Entsorgung desaktivieren (siehe "Entsorgung")!
Durchführung
In einem 50 mL Becherglas werden 10 g Kaliumpermanganat eingewogen und auf die feuerfeste Unterlage im Abzug in Form eines kleinen Haufens gegeben. Mit einem Spatel wird eine kleine Mulde an der Spitze des Haufens geformt. Aus der Spritze werden vorsichtig 2 mL Glycerin hinzugefügt und der Frontschieber zügig geschlossen. Die Reaktion startet üblicherweise unter Flammenentwicklung innerhalb von 10-20 Sekunden.
Anmerkung
Es wurde sehr feinkörniges Kaliumpermanganat verwendet. Eventuell kann ein vorhergehendes Verreiben im Mörser notwendig sein.
Die Verwendung von Eisenpulver - wie an mancher Stelle angegeben - ist nach unseren Erfahrungen nicht notwendig.
Entsorgung
Den ausgekühlten Reaktionsrückstand versetzt man mit Wasser (Desaktivierung) und entsorgt das gesammelte Waschwasser im Behälter für anorganische Schwermetallabfälle. Die Spritze kann nach dem Auswachen mit dest. Wasser erneut verwendet werden oder wird im Hausmüll entsorgt (Glycerin ist kein Gefahrstoff, der eine gesonderte Entsorgung erfordert) .
Erklärung
Kaliumpermanganat reagiert exotherm (unter Hitzeentwicklung) mit dem Glycerin. Durch die Wärme wird die Reaktion beschleunigt, so dass es zu einem thermischen Durchgehen (engl. runaway) kommt und sich die Mischung entzündet.
C3H5(OH)3 + KMnO4 → CO2 + K2CO3 + H2O + K2MnO4 + MnO2 + Mn2O3
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Glycerin (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemische Ampel
Freie Fahrt mit Chemie! Durch die richtige Dosis Sauerstoff, lässt sich auch ein Ampelsignal steuern - zugegeben - nur nachbilden. Dieses schöne Experiment mit Indigocarmin führt in die Welt der organischen Farbstoffe und Redox-Reaktionen ein. Durch Auslotung dieses komplexen Systems, erreicht man den schönen Effekt der chemischen Ampel.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Freie Fahrt mit Chemie! Durch die richtige Dosis Sauerstoff, lässt sich auch ein Ampelsignal steuern - zugegeben - nur nachbilden. Dieses schöne Experiment mit Indigocarmin führt in die Welt der organischen Farbstoffe und Redox-Reaktionen ein. Durch Auslotung dieses komplexen Systems, erreicht man den schönen Effekt der chemischen Ampel.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
500 mL Laborgewindeflasche, 250 mL Becherglas, 500 mL Erlenmeyerkolben, Magnetrührer mit Heizplatte, Thermometer, Rührfisch, Waage, Spatel
Chemikalien
Indigocarmin
Glucose
Natriumhydroxid
Durchführung
In das 250 mL Becherglas werden 10 g Glucose eigewogen und mit 40 mL dest. Wasser verdünnt. In den Erlenmeyerkolben kommen 4,44 g Natriumhydroxid, die ihrerseits wieder mit 277,4 mL Wasser verdünnt werden. Die Natronlauge erhitzt man dann am Magnetrührer auf eine Temperatur von 40 - 50 °C.
In eine 500 mL Laborglasflasche werden dann 0,04 g Indigocarmin (eine Spatelspitze) gegeben. Es kommt die warme Natronlauge hinzu und zum Schluss die Glucose-Lösung. Die Flasche wird gut zugeschraubt und der Inhalt durch Schütteln gut vermischt.
Nach wenigen Sekunden ändert sich die Farbe von grün nach rot und geht anschließend ins Gelbe über. Durch einmal schütteln wird die Lösung wieder rot, zweimal und sie ist grün. Dies kann ein paar Mal wiederholt werden, danach verblassen die Farben.
Entsorgung
Die Lösung wird mit verdünnter Salzsäure neutralisiert und gut verdünnt dem Abwasser zugeführt.
Erklärung
Komplexe Bindungssysteme, in denen sich Elektronen freier Bewegen oder angeregt werden können (z.B. bei Doppelbindungen), sorgen für Farbe. Werden diese Bindungssysteme durch chemische Reaktionen verändert, verändert sich auch die Farbe.
Indigocarmin ist ein pH Indikator. Durch Natronlauge wird ein Teil deprotoniert - die entstehende Struktur ist gelb gefärbt. Aus der Mischung von blau und gelb entsteht grün.
Die deprotonierte Form kann dann von Glucose zum gelben Leuko-Indigo reduziert werden. Die Gleichgewichte verschieben sich so, dass keine blaue Form mehr vorhanden ist. Diese Reduktion verläuft über eine rote Zwischenstufe mit Radikal-Anion.
Die Reduktion wird durch Luftsauerstoff, der beim Schütteln in die Lösung gebracht wird, umgekehrt werden. Dabei oxidiert man das gelbe Leuko-Indigo über die rote Zwischenstufe wieder zu einer blau/gelben (für unser Auge grünen) Mischung.
Die Reaktion geht solange, bis die Glucose verbraucht ist oder der Farbstoff oxidativ zerstört wurde.
Fotos
Video
Literatur
Dr. Fritz Struber (YouTube: Helicochem)
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Indigocarmin (Kein gefährlicher Stoff nach GHS)
Glucose (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.