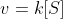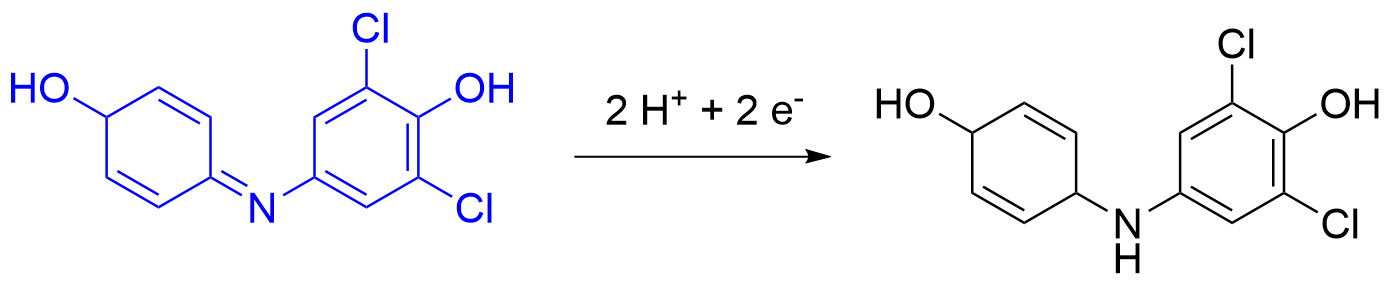Michaelis-Menten-Kinetik von Alpha-Amylase
α-Amylasen spalten Amylose (neben Amylopektin einem Bestandteil von Stärke), wodurch unter anderem Maltose entsteht. Durch Nachweis der Stärke mittels Lugol’scher Lösung und Quantifizierung über UV/VIS Spektroskopie lässt sich die Enzymkinetik bestimmen, wodurch die Michaelis-Menten-Parameter bestimmt werden können.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
α-Amylasen spalten Amylose (neben Amylopektin einem Bestandteil von Stärke), wodurch unter anderem Maltose entsteht. Durch Nachweis der Stärke mittels Lugol’scher Lösung und Quantifizierung über UV/VIS Spektroskopie lässt sich die Enzymkinetik bestimmen, wodurch die Michaelis-Menten-Parameter bestimmt werden können.
Schwierigkeitsgrad
Schülerexperiment - schwer
Geräte
50 mL Becherglas (2 x), 100 mL Messkolben, Reagenzglas-Ständer, 15 mL Falcon Tubes, Mikroliterpipetten (5000 µL, 1000 µL & 10 µL), Stoppuhr, Magnetrührer mit Heizplatte und Rührfisch, Küvetten (Halbmikro), UV/VIS-Spektrometer, Mikrowelle, Analysenwaage, Computer mit MS Excel (oder anderweitiges Tabellenkalkulationsprogramm)
Chemikalien
lösliche Stärke
α-Amylase aus Bacillus amyloliquefaciens (> 250 U/g)
Lugol’sche Lösung
Durchführung
Zuerst wird eine 1 mg/mL Stärkelösung durch Einwiegen von 100 mg löslicher Stärke und Verdünnen auf 100 mL Wasser hergestellt. Die Stärke muss in der Siedehitze gelöst werden.
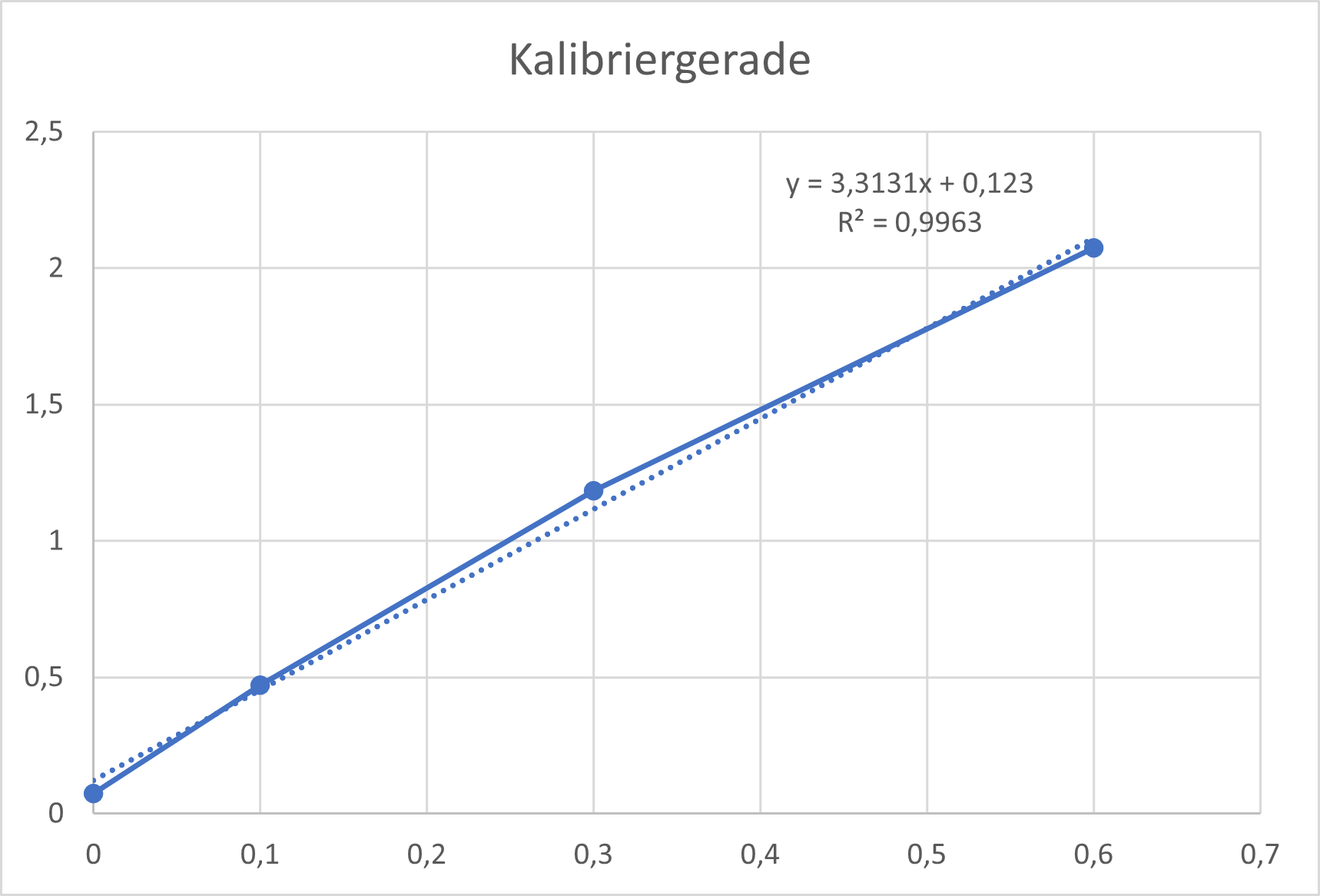
Zur Herstellung der Kalibriergeraden werden von dieser Stärkelösung 0, 100, 300 und 600 µL jeweils mit der entsprechenden Menge Wasser auf 1000 µL verdünnt und zur Gänze in eine Lösung aus 3 mL Wasser und einem Tropfen Iod-Kaliumiodidlösung überführt. Die Absorption bei 600 nm wird daraufhin zügig am UV/VIS-Spektrometer bestimmt.
Zur Reaktion werden 10 mL einer Stärkelösung mit einer Konzentration von 0,5, 0,75 und 1,0 mg/mL zusammen mit 1 µL einer verdünnten Amylase-Lösung angesetzt (10 µL Amylase auf 990 µL dest. Wasser). Nach 1, 3, 5, 10, 15, 30 und 45 min werden 1000 µL als Probe entnommen und wiederum in eine Lösung aus 1 Tropfen Iod-Kaliumiodid-Lösung in 3 mL dest. Wasser überführt. Die Absorption bei 600 nm wird daraufhin zügig am UV/VIS-Spektrometer bestimmt.
| Zeit [min] | Absorption | ||
|---|---|---|---|
| 1,00 mg/mL | 0,75 mg/mL | 0,50 mg/mL | |
| 1 | 2,182 | 1,461 | 1,095 |
| 3 | 1,816 | 1,194 | 0,910 |
| 5 | 1,467 | 0,901 | 0,716 |
| 10 | 1,087 | 0,618 | 0,501 |
| 15 | 0,826 | 0,467 | 0,422 |
| 30 | 0,591 | 0,278 | 0,320 |
| 45 | 0,472 | 0,217 | 0,280 |
Das kann natürlich auch grafisch dargestellt werden:
Zur Datenauswertung werden die Absorptions/Zeit-Verläufe mittels der Kalibriergerade in Konzentrations/Zeit-Verläufe umgerechnet:
| Zeit [min] | Konzentration [mg/mL] | ||
|---|---|---|---|
| 1,00 mg/mL | 0,75 mg/mL | 0,50 mg/mL | |
| 1 | 0,621 | 0,404 | 0,293 |
| 3 | 0,511 | 0,323 | 0,238 |
| 5 | 0,406 | 0,235 | 0,179 |
| 10 | 0,291 | 0,149 | 0,114 |
| 15 | 0,212 | 0,104 | 0,090 |
| 30 | 0,141 | 0,047 | 0,059 |
| 45 | 0,105 | 0,028 | 0,047 |
Danach erfolgt die Bestimmung der Anfangsgeschwindigkeit durch lineare Regression anhand der ersten drei Messpunkte:
Entsorgung
Alle Lösungen, die Iod bzw. Kaliumiodid enthalten, werden als halogenhaltige Salzlösung entsorgt.
Erklärung
Was versteht man unter der “Geschwindigkeit” einer chemischen Reaktion?
Zur Beantwortung dieser Frage wird die folgende Reaktion betrachtet, bei der ein Substrat (S) irreversibel zu einem Produkt (P) umgewandelt wird:
Die Geschwindigkeit der Reaktion würde dann als Änderung der Produktkonzentration (oder negative Änderung der Substratkonzentration) pro Zeiteinheit definiert werden:
Die Reaktionsgeschwindigkeit steht über einen Proportionalitätsfaktor - der Geschwindigkeitskonstante - in Zusammenhang mit der Substratkonzentration:
Hierbei handelt es sich um eine Reaktion 1. Ordnung, da die Geschwindigkeitskonstante in einem linearen Zusammenhang mit der Substratkonzentration steht. Auch andere Reaktionsordnungen sind möglich, beispielsweise ist bei einer Reaktion 0. Ordnung die Geschwindigkeit unabhängig von der Konzentration der Ausgangssubstanz.
Die Reaktionsgeschwindigkeit muss experimentell ermittelt werden, indem im Verlauf der Reaktion die Zunahme des Produkts (oder Abnahme des Edukts) beispielsweise über die Änderung der Absorption gemessen wird. Dabei zeigt sich, dass sich die Konzentration anfangs schnell ändert, sich aber irgendwann einer Gleichgewichtskonzentration annähert - die Reaktionsgeschwindigkeit ist also über den Reaktionsverlauf nicht konstant.
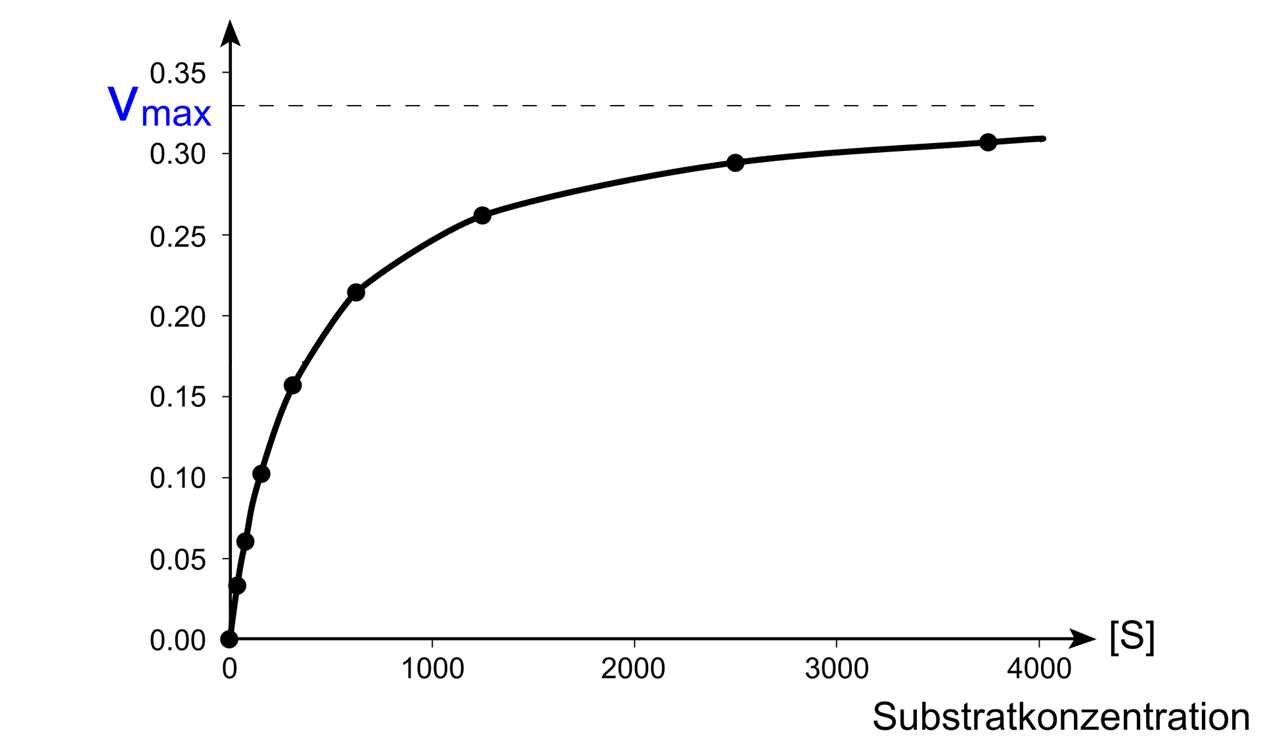
Wird nun die Anfangsgeschwindigkeit von enzymatisch katalysierten Reaktionen bei unterschiedlichen Substratkonzentrationen gemessen, zeigt sich, dass die Anfangsgeschwindigkeit bei steigender Substratkonzentrationen anfangs linear zunimmt, bis sie sich irgendwann einer Maximalgeschwindigkeit vmax annähert:
Zur Beschreibung dieser kinetischen Eigenschaft schlugen Leonor Michealis und Maud Menten 1913 ein einfaches Modell vor. Hierbei formulierten sie einen Enzym-Substrat-Komplex, der als Zwischenprodukt auftreten muss:
Durch drei Annahmen kann das Modell vereinfacht werden:
Die Reaktion wird zum Zeitpunkt t ≈ 0 betrachtet, wodurch noch kein Produkt gebildet wurde und der Enzym-Substrat-Komplex irreversibel zum Produkt zerfällt
Die Konzentration des Enzym-Substrat-Komplexes ist konstant, dessen Bildung und Zerfall also gleich schnell (Steady-State)
Die Konzentration des Substrats ist deutlich höher als jene des Enzyms, die Konzentration an im Enzym gebundenem Substrat ist folglich gegenüber der Gesamtsubstratkonzentration vernachlässigbar.
Dadurch vereinfacht sich die Reaktionsgleichung zu folgendem Ausdruck und die Michealis-Menten-Gleichung lässt sich daraus ableiten (zur exakten Herleitung sei auf einschlägige Literatur verwiesen):
Die Michaelis-Menten-Konstante gibt folglich die Substratkonzentration an, bei der die Reaktionsgeschwindigkeit die Hälfte ihres Maximalwertes erreicht. KM ist ein wichtiges Charakteristikum enzymatisch katalysierter Reaktionen und insbesondere für die biologische Funktion der Enzyme von Bedeutung.
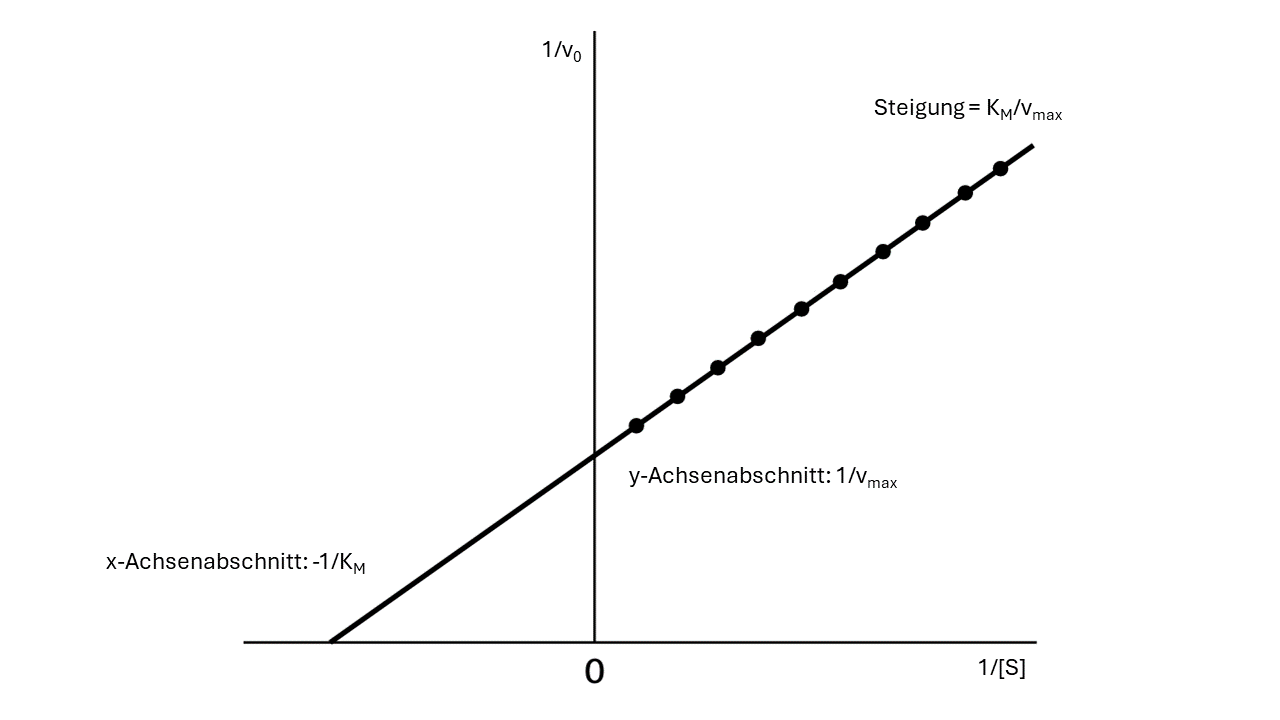
Doch wie werden KM und vmax nun bestimmt? Dazu wird die Michaelis-Menten-Gleichung zuerst auf ihre doppelt-reziproke Darstellung umgeformt, wodurch eine Geradengleichung erhalten wird:
Video
Literatur
Cochran et al. "Kinetic Analysis of Amylase Using Quantitative Benedict's and Iodine Starch Reagents" J. Chem. Educ. 85, 3 (2008): 401
Berg, Jeremy M., and John L. Tymoczko. Stryer biochemie. Vol. 8. Heidelberg: Springer Spektrum, 2018.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Lösliche Stärke (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Schwefelsäure und Zucker
Konzentrierte Schwefelsäure ist eine starke Säure, die besonders gut mit organischen Materialien reagiert und stark hygroskopisch wirkt. Beim Experiment "Schwefelsäure + Zucker" wird genau dieser Sachverhalt untersucht.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Konzentrierte Schwefelsäure ist eine starke Säure, die besonders gut mit organischen Materialien reagiert und stark hygroskopisch wirkt. Beim Experiment "Schwefelsäure + Zucker" wird genau dieser Sachverhalt untersucht.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Becherglas 400 mL, Becherglas 50 mL, Messzylinder, Glasstab, säurefeste Handschuhe, Schutzbrille
Chemikalien
konz. 96% Schwefelsäure
Zucker (Saccharose)
Hinweis
Durchführung im Abzug!
Durchführung
In ein 400 mL Becherglas werden 70 g Zucker vorgelegt, mit 10 mL Wasser befeuchtet und mittels Glasstab umgerüht.
Anschließend werden mit einem Messzylinder 50 mL konz. Schwefelsäure hinzugegeben und zugig mit dem Glasstab erneut umgerüht.
Entsorgung
Nach Ende und Abkühlen der Reaktion wird das Produkt mit einer Lauge (z.B. Natriumcarbonat) neutralisiert und gefiltert. Feste Rückstände können im Abfall, flüssige Rückstände im Ausguss entsorgt werden.
Erklärung
Die konzentrierte Schwefelsäure reagiert unter Gasbildung immer schneller mit dem angefeuchteten Zucker. Im Laufe der Zeit bildet sich eine "Kohlenstoff-Schlange" aus, die langsam nach oben wächst.
Konzentrierte Schwefelsäure ist neben ihrer starken Säurewirkung auch stark hygroskopisch (=Wasseranziehend). Formal "zieht" die Schwefelsäure in diesem Versuch das Wasser aus den Zuckermolekülen:
Diese Tatsache führte historisch auch zur Bezeichnung "Kohle(n)hydrate" - welche jedoch eigentlich bei genauerer Betrachtung nicht korrekt ist. Tatsächlich kommt es allerdings zu Redox-Reaktionen der Kohlenstoff-Atome des Zuckers, wobei schweflige Säure und Kohlenstoffdioxid entstehen:
Die schweflige Säure zerfällt ihrerseits in Schwefeldioxid und Wasser:
Die entstehenden Gase Wasserdampf, Kohlenstoffdioxid und Schwefeldioxid treiben die Masse in die Höhe. Auf einem ähnlichen Prinzip basiert auch das Experiment der Schlange des Pharao.
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Saccharose (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Hill-Reaktion mit DCPIP
Chloroplasten haben die Fähigkeit, unter Einwirkung von Licht, Wasser photolytisch zu H+ Ionen und Sauerstoff zu spalten. Dies kann man in vitro mit einem künstlichen Elektronenakzeptor – auch Hill-Reagenz genannt – nachweisen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Schwierigkeitsgrad
Schülerexperiment - schwer
Geräte
Frische Blätter, Laborwaage, Wägeschiffchen, 250 mL Becherglas, Standmixer, Lacksieb, Trichter, Falco-Tube 50 mL, Kühlzentrifuge mit passendem Rotor, Pipette 1000 – 5000 µL mit passenden Pipettenspitzen, Reagenzgläser, Halogenscheinwerfer 1000 W, Alufolie, Becherglas 2000 mL, Spatel, Messkolben 500 mL, Eis, Magnetrührer mit Rührfisch (optional), UV/VIS-Spektrometer mit Küvetten (optional).
Chemikalien
Saccharose
Kaliumchlorid
Dinatriumhydrogenphosphat Heptahydrat
Natriumdihydrogenphosphat Monohydrat
2,6-Dichlorphenolindophenol Lösung, wässrig (c = 0.03 %)
Durchführung
Herstellung Extraktionspuffer
500 mL Extraktionspuffer (0.5 M Saccharose und 0.01 M Kaliumchlorid in 0.05 M Phosphatpuffer bei pH 7.0) werden hergestellt aus:
Saccharose: 85.58 g
Kaliumchlorid 0.37 g
Dinatriumhydrogenphosphat Heptahydrat: 3.87 g
Natriumdihydrogenphosphat Monohydrat: 1.46 g
Der Lösevorgang dauert sehr lange, optional kann mit einem Magnetrührer gerührt werden. Anschließend wird der Extraktionspuffer auf 4 °C gekühlt
Hill-Reaktion
Ein paar frische Löwenzahnblätter o.Ä. werden mit 50 mL Extraktionspuffer versehen und im Standmixer in kurzen Intervallen (maximal 4 mal 5 s) zerkleinert.
Mittels Filtration durch ein Lacksieb, werden die groben Bestandteile von den feinen Chloroplasten getrennt. Die Filtrationsvorlage ist dabei mit Eis zu kühlen!
Um möglichst viele der unerwünschten löslichen Bestandteile zu entfernen, wird bei 7800 RPM und 4 °C für 5 min zentrifugiert und der Überstand verworfen. Anschließend wird mit frischem Extraktionspuffer auf ungefähr das gleiche Volumen aufgefüllt, kurz geschüttelt und erneut zentrifugiert. Nach erneutem Verwerfen des Überstandes wird wieder mit frischem Extraktionspuffer aufgefüllt (ca. 15 mL sind ausreichend).
Nun werden vier Reagenzgläser nach folgendem Schema vorbereitet. Ein Reagenzglas (Nr. 4) wird dabei vollständig mit Alufolie umwickelt, um es vor Licht zu schützen:
Reagenzglas 1 (Positivprobe):
Extraktionspuffer: 4 mL
DCPIP (c = 0.03%): 1 mL
Reagenzglas 2 (Hell):
Chloroplasten-Suspension: 2 mL
Extraktionspuffer: 2 mL
DCPIP (c = 0.03%): 1 mL
Reagenzglas 3 (Negativprobe):
Chloroplasten-Suspension: 2 mL
Extraktionspuffer: 3 mL
Reagenzglas 4 (Dunkel):
Chloroplasten-Suspension: 2 mL
Extraktionspuffer: 2 mL
DCPIP (c = 0.03%): 1 mL
Die Reagenzgläser werden dann mittels Halogenscheinwerfer belichtet, wobei zwischen Scheinwerfer und den Reagenzgläsern ein großes Becherglas mit Wasser gestellt wird, um sämtliche Wärme zu absorbieren. Nach ca. 15 min werden die Reagenzgläser miteinander verglichen.
Um eine quantitative Ausarbeitung zu ermöglichen, kann den Reagenzgläsern 2 und 4 jeweils 1 mL entnommen, die festen Bestandteile durch Zentrifugation entfernt und die Absorption bei 600 nm mittels UV/VIS-Spektrometer gegen Reagenzglas 3 als Referenz gemessen werden. Die Absorption von Reagenzglas 1 wird gegen den Puffer als Referenz gemessen.
Entsorgung
Alle Lösungen, die 2,6-Dichlorphenolindophenol enthalten, müssen als halogenhaltiger Abfall entsorgt werden. Der Extraktionspuffer kann über das Abwasser entsorgt werden.
Erklärung
In vitro kann man das mit einem künstlichen Elektronenakzeptor nachweisen: Isolierte Chloroplasten sind in der Lage DCPIP unter Lichteinwirkung zu reduzieren, wobei reduziertes DCPIP nicht mehr blau, sondern farblos erscheint.
Vergleicht man nun die Absorptionswerte bei 600 nm, dem Extinktionsmaximum von DCPIP, ist ersichtlich, dass die Werte des ersten Reagenzglases (nur DCPIP) und des 4. Reagenzglases (DCPIP + Chloroplasten, dunkel) ähnlich groß sind. Es wurde also - wie erwartet - kaum DCPIP reduziert.
Der Inhalt aus Reagenzglas 2 weist jedoch nach der Reaktion eine viel geringere Absorption auf, da hier das DCPIP teilweise reduziert wurde.
Robert Hill gelang es auf diese Weise 1937 nachzuweisen, dass bei der Photosynthese der Sauerstoff durch lichtabhängige Spaltung von Wasser entsteht und nicht wie zuvor vermutet durch Reduktion von Kohlendioxid. Spätere Studien mit isotopenmarkiertem Wasser bestätigten diese Aussage.
Video
Literatur
Hill, Robin. "Oxygen evolved by isolated chloroplasts." Nature 139.3525 (1937): 881-882.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Saccharose (Kein Gefahrstoff nach GHS)
Kaliumchlorid (Kein Gefahrstoff nach GHS)
Dinatriumhydrogenphosphat Heptahydrat (Kein Gefahrstoff nach GHS)
Natriumdihydrogenphosphat Monohydrat (Kein Gefahrstoff nach GHS)
2,6-Dichlorphenolindophenol Lösung, wässrig, c = 0.03 % (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemischer Regenbogen aus Tomatensaft
Stoffe erscheinen uns Menschen farbig, wenn diese Licht einer bestimmten Wellenlänge im VIS-Bereich zu absorbieren. Dies wird durch delokalisierte π-Elektronensysteme ermöglicht wobei gilt: Je größer das delokalisierte Elektronensystem eines Moleküls ist, desto längere Wellenlängen absorbiert es. Der nicht absorbierte und somit reflektierte Teil des Lichts ist als Komplementärfarbe dazu sichtbar. Dieser Zusammenhang lässt sich mit dem folgenden Experiment eindrucksvoll demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Stoffe erscheinen uns Menschen farbig, wenn diese Licht einer bestimmten Wellenlänge im VIS-Bereich zu absorbieren. Dies kann z.B. durch delokalisierte π-Elektronensysteme ermöglicht werden wobei gilt: Je größer das delokalisierte Elektronensystem eines Moleküls ist, desto längere Wellenlängen - bzw. energieärmeres Licht - absorbiert es. Der nicht absorbierte und somit reflektierte Teil des Lichts ist als Komplementärfarbe dazu sichtbar. Dieser Zusammenhang lässt sich mit dem folgenden Experiment eindrucksvoll demonstrieren.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
250 ml Erlenmeyerkolben, Magnetrührer mit Heizplatte, Rührfisch, 100 ml Standzylinder, Glasstab
Chemikalien
Bromwasser (gesättigt)
Hinweis
Durchführung
In einem Erlenmeyerkolben werden ca. 80 ml handelsüblicher Tomatensaft erwärmt und dann in den Standzylinder überführt. Anschließend werden vorsichtig 20 ml gesättigtes Bromwasser zum Tomatensaft gegeben und mit einem Glasstab kurz umgerührt.
Entsorgung
Der bromwasserhaltige Tomatensaft wird so lange mit gesättigter Natriumthiosulfat-Lösung versetzt, bis die Bromfarbe verschwunden ist. Anschließend kann die Lösung im halogenhaltigen Abfall entsorgt werden.
Erklärung
Video
Literatur
Trickkiste Chemie, Bayerischer Schulbuch Verlag, München, 1998, S. 155ff.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Wasserstoff/Sauerstoff Brennstoffzelle
Wasserstoff wird eine große Rolle bei der Energiewende als sauberer und umweltfreundlicher Brennstoff zur Energieerzeugung zugeschrieben. Im folgenden Versuch wird eine sehr einfache Wasserstoff-Sauerstoff-Brennstoffzelle als Demonstration dieses Prinzips gebaut und anschließend der Kurzschlussstrom und die Leerlaufspannung gemessen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Wasserstoff wird eine große Rolle bei der Energiewende als sauberer und umweltfreundlicher Energieträger zugeschrieben. Im folgenden Versuch wird eine sehr einfache Wasserstoff-Sauerstoff-Brennstoffzelle als Demonstration dieses Prinzips gebaut und anschließend der Kurzschlussstrom und die Leerlaufspannung gemessen.
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
Becherglas 500 ml, Kristallisierschale, 2 Kohleelektroden, Stativmaterial, Multimeter, Labornetzgerät, Kabel, Krokodilklemmen
Chemikalien
Kaliumhydroxid
Durchführung
In dem Becherglas wird eine ca. 6 molare Kalilauge aus 135 g Kaliumhydroxid und 400 ml Wasser vorbereitet. Anschließend wird damit die Kristallisierschale befüllt und die Kohleelektroden mittels Klemmen mit ausreichend Abstand zueinander sowie zum Glas befestigt.
Die Elektroden werden nun über Krokodilklemmen mit dem Labornetzgerät verbunden und für 2 Minuten eine Spannung von 4,5 Volt angelegt (je nach Zellwiderstand ergeben sich 2-3 A). Im Anschluss daran wird das Netzgerät ausgeschalten, die Klemmen entfernt und mit einem Multimeter die Leerlaufspannung (ca. 1.7 V) sowie der Kurzschlussstrom (Peak: 130 mA) gemessen.
Entsorgung
Die entstandene Lauge wird neutralisiert und kann im Abguss entsorgt werden.
Erklärung
Die dabei entstehenden Gase H2 und O2 diffundieren in die feinporige Kohleoberfläche ein und reichen zur kurzzeitigen Demonstration des Prinzips aus.
Wird nun das Netzgerät ausgeschalten und ein Verbraucher (Multimeter) an den Kreislauf angeschlossen läuft folgende Rückreaktion ab:
Insgesamt läuft somit folgende Reaktion zwischen Wasserstoff und Sauerstoff unter Energieabgabe zu Wasser ab:
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Herstellung einer Farbstoffsolarzelle (Grätzel-Zelle)
Die Erzeugung von hochreinem Silizium für Photovoltaikanlagen ist mit hohem Energie und Ressourcenaufwand verbunden. Michael Grätzel hat eine alternative Technik maßgeblich mitentwickelt, um Licht in elektrischen Strom umzuwandeln. Zwar sind diese Solarzellen, die auf Basis eines Farbstoffes und TiO2 als Halbleiter basieren günstig herzustellen, erreichen aber nicht die Wirkungsgrade und Lebensdauern herkömmlicher Module auf Basis von Silizium.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
FTO-Glas (50 x 50 mm) bzw. ITO-Glas (50 x 50 mm), Bechergläser, Klebeband, Spritzen, Analysenwaage, Pasteurpipetten, Heizplatte, Bunsenbrenner, Multimeter, Flüssigseife, Glasstab, Spatel, Trockenschrank, Wattestäbchen, starke Lichtquelle (z.B. Halogenscheinwerfer)
Chemikalien
Titandioxid Aeroxide® P25
Eisessig
Blattextrakt
Iod
Kaliumiodid
Glycerin
Hinweis
Durchführung
Zuerst wird ITO-Glas mit der leitfähigen Seite nach oben (Prüfung mittels Multimeter) mit Klebeband auf einem Blatt Küchenpapier befestigt. Das Klebeband sollte so befestigt werden, dass ein 1 cm dicker Rand auf drei Kanten des ITO-Glases entsteht. Nun werden 200 mg Titandioxid in ein 25 mL Becherglas eingewogen, mit ungefähr 1 ml Eisessig und unter Zugabe von einem Tropfen Flüssigseife zu einer dünnflüssigen Suspension verrührt. Diese Suspension wird auf die nicht abgeklebte Stelle des ITO-Glases gegossen und gleichmäßig verteilt. Durch Schrägstellen tropft überschüssiges Material ab, sodass sich nach dem Trocknen eine sehr gleichmäßige Schichtdicke an Titandioxid ausbildet.
Nach einer Trocknungszeit von 10 min bei Raumtemperatur wird weitere 10 min bei 50 °C im Trockenschrank getrocknet, um die letzten Spuren an Eisessig zu verdampfen. Danach werden die Klebebandstreifen entfernt und evtl. an der Unterseite oder den Rändern anhaftendes Titandioxid mit etwas Küchenpapier entfernt. Damit das Titandioxid am Glas besser haftet, wird auf einer Heizplatte bei 300 – 325 °C für 15 min erhitzt.
Nach dem Erkalten wird das ITO-Glas für 5 min in einen Blattextrakt (Herstellung ist hier beschrieben) gelegt, damit Chlorophyll an dem Titandioxid anhaftet. Danach wird überschüssiger Blattextrakt auf der Rückseite und den Rändern mit einem Küchenpapier entfernt.
Als Kathode wird eine weitere ITO-Glasplatte verwendet. Diese wird mit der leitenden Seite in die Sparflamme des Bunsenbrenners gehalten, so dass sich Ruß abscheidet. Nun wird mit einem Wattestäbchen überschüssiger Ruß entfernt, so dass Ränder mit denselben Maßen wie bei der Titandioxid-Kathode gebildet werden.
Zur Herstellung des Elektrolyten wird 1 mL wasserfreies Glycerin mit einem Körnchen Iod und einer Spatelspitze Kaliumiodid versehen. Ungefähr 10 Tropfen dieser Lösung werden dann auf das Titandioxid aufgebracht und die Kathode auf die Anode gelegt. Damit die Konstruktion nicht verrutscht, werden noch zwei Klammern angebracht.
Unter Belichtung mit einer starken Lichtquelle (z.B. einem Halogenscheinwerfer) kann mittels Multimeter die Spannung und der Kurzschlussstrom gemessen werden.
Entsorgung
Die ITO-Glasplatten können gereinigt und wiederverwendet werden. Das Glycerin-Iod-Gemisch wird als halogenhaltiger Abfall entsorgt.
Erklärung
In einem ersten Schritt führt die Absorption von Licht zur Anhebung zweier Farbstoffmoleküle vom Grundzustand in den angeregten Zustand. Von diesem angeregten Zustand fließen die Elektronen in das Leitungsband des Halbleiters, wodurch das Farbstoffmolekül zurück in den Grundzustand unter Ausbildung eines Elektronenlochs fällt. Die Elektronen fließen aus dem Leitungsband über die Anode und den elektrischen Verbraucher zu der Kathode, wo Iod zu Iodid reduziert wird. Das Elektronenloch im Farbstoffmolekül oxidiert wiederum Iodid zu Iod, es erhält dabei zwei Elektronen, wodurch der Kreis geschlossen ist.
Die maximale Spannung ergibt sich aus der Differenz des Fermi-Levels des Titandioxids und des Redoxpotentials von Iod/Iodid (ca. 0.7 V). Die Stromstärke (also Ladungen pro Leiterquerschnitt pro Zeiteinheit) hängt davon ab, wie viele Farbstoffmoleküle tatsächlich angeregt werden. Außerdem könnte das Elektron aus dem Farbstoff oder dem Titandioxid das Iod direkt reduzieren, wodurch Ladungsträger „verloren“ gehen.
Generell sind aber diese Farbstoffsolarzellen bezüglich Effizienz und Lebensdauer den herkömmlichen Siliziumzellen - noch - weit unterlegen.
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Blattextrakt (Ethanol)
Glycerin (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Lithium in Wasser
Alkalimetalle bilden mit Wasser unter Freisetzung von Wasserstoff Alkalilaugen. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Lithium im Wasser demonstriert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser unter Freisetzung von Wasserstoff Alkalilaugen. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Lithium im Wasser demonstriert.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer, Streichhölzer
Chemikalien
Lithium
Durchführung
Die Wanne wird zu dreiviertel mit Wasser befüllt. Lithium wird mittels Pinzette und Messer in mehrere kleine Stücke (stecknadel- bis erbsengroß) zerteilt und diese anschließend mit einem Kuchentuch von der Schutzflüssigkeit befreit.
Lithium im direkten Kontakt mit Wasser:
Ein Stück Lithium wird mit einer Pinzette direkt auf die Wasseroberfläche gegeben. Das Lithium „tanzt“ unter Wasserstoffabgabe über die Wasseroberfläche, entzündet sich jedoch nicht von selbst.
Lithium auf Filterpapier im Wasser:
Nun wird ein Filterpapier auf die Wasseroberfläche gelegt, worauf ein Stück Lithium platziert wird. Wieder bildet sich Wasserstoff, doch trotz der Tatsache, dass sich das Stück diesmal nicht vom Fleck bewegt und es somit zu einer vielfach höheren Wasserstoffkonzentration kommt, beginnt das Lithium (anders als Natrium) nicht zu brennen.
Entzünden von Lithium im Wasser:
Es wird ein Stück Lithium direkt im Wasser platziert, diesmal jedoch sofort im Anschluss mittels Streichholz entzündet. Das Lithium entzündet sich und verbrennt mit charakteristisch roter Flamme.
Anmerkung
Zum Nachweis des entstehenden Lithiumhydroxids kann das Wasser in der Kunststoffwanne mit etwas Phenolphthalein-Lösung versetzt werden.
Entsorgung
Die entstandene Lauge wird neutralisiert und kann im Abguss entsorgt werden.
Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Lithiumstückchen zu quenchen.
Erklärung
Wenn Alkalimetalle wie Lithium mit Wasser in Kontakt kommen, läuft eine exotherme Reaktion unter Wasserstofffreisetzung ab.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Flüssig-Flüssig-Extraktion von Beta-Carotin
In vielen Lebensmitteln kommt Beta-Carotin vor, Grünkohl hat dabei den höchsten Gehalt von ca. 9mg/100g. Es ist eine wichtige Vorstufe von Retinol (Vitamin A) und wird daher auch gerne als Provitamin A bezeichnet. In Pflanzen ist es neben Chlorophyll auch an der Lichtaufnahme zur Fotosynthese beteiligt. Als Demonstration einer Flüssig-Flüssig-Extraktion wird in diesem Experiment Beta-Carotin aus Karotten isoliert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
In vielen Lebensmitteln kommt Beta-Carotin vor, Grünkohl hat dabei den höchsten Gehalt von ca. 9mg/100g. Es ist eine wichtige Vorstufe von Retinol (Vitamin A) und wird daher auch gerne als Provitamin A bezeichnet. In Pflanzen ist es neben Chlorophyll auch an der Lichtaufnahme zur Fotosynthese beteiligt (siehe Versuch „Chromatographie von Blattfarbstoffen“). Als Demonstration einer Flüssig-Flüssig-Extraktion wird in diesem Experiment Beta-Carotin aus Karotten isoliert.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Standmixer, Magnetrührer mit Rührfisch, 2 Erlenmeyerkolben 100 mL/50 mL, (Scheide-)trichter, Spatel, Messzylinder, Küvetten aus PS, Pasteurpipetten, Laborstativset, Filterpapier
Chemikalien
Natriumcarbonat
Eisessig
Petrolether
Natriumsulfat
Durchführung
Eine Hand voll geschnittener Karotten werden in einem Standmixer mit so viel Wasser versetzt, dass durch Pürieren ein dünnflüssiger Brei entsteht.
Dieser Brei wird in einen 100 mL Erlenmeyerkolben überführt, mit einem Spatel Natrium- oder Kaliumcarbonat versehen und für 5 min gekocht.
Nach dem Erkalten wird tropfenweise (!) Eisessig mit einer Pasteurpipette hinzugegeben, bis keine Gasentwicklung mehr zu verzeichnen ist. Achtung, die Lösung neigt zum Überschäumen.
Der Inhalt des Erlenmeyerkolbens wird in einen Scheidetrichter überführt und mit etwa 20 mL Petrolether extrahiert. Die untere, wässrige Phase wird abgetrennt und verworfen, während die organische Phase mit gesättigter Kochsalzlösung gewaschen wird.
Ein 50 mL Erlenmeyerkolben wird mit einem Trichter versehen, in dem ein Faltenfilter platziert wird. Darin werden 1-2 Spatel wasserfreies Natriumsulfat vorgelegt und die organische Phase in den Trichter abgelassen.
Die filtrierte Lösung wird in eine Küvette pipettiert und davon ein UV/VIS-Spektrometer aufgenommen.
Entsorgung
Alle Lösungsmittel kommen in den Behälter für organische, halogenfreie Abfälle. Die wässrige Phase wird als saurer Abfall entsorgt.
Erklärung
Beta-Carotin löst sich als sehr unpolares Molekül deutlich besser in Petrolether, als in – sehr polarem – Wasser („similia similibus solvuntur“ – Gleiches löst Gleiches).
Auch in Blättern kommt Beta-Carotin vor (siehe Versuch: „Chromatographie von Blattfarbstoffen“), dort dient es zur Photosynthese als Chromophor und schützt überdies hinaus vor schädlichem UV-Licht.
Werden das UV/VIS-Spektrum eines Blattextrakts und jenes von Beta-Carotin betrachtet, lässt sich in beiden das Absorbtionsmaximum von Beta-Carotin bei 430 nm finden.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumsulfat (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Elektrolyse im Mikromaßstab
Bei der Elektrolyse wird eine Redox-Reaktion durch elektrischen Strom erzwungen. Dieses Verfahren ist vor allem in der chemischen Industrie von Bedeutung - so werden Edelmetalle durch Elektrolyse raffiniert. Aber auch die Erzeugung von Chlor, Natronlauge und (zukünftig) Wasserstoff wird durch Elektrolyse bewerkstelligt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bei der Elektrolyse wird eine Redox-Reaktion durch elektrischen Strom erzwungen. Dieses Verfahren ist vor allem in der chemischen Industrie von Bedeutung - so werden Edelmetalle durch Elektrolyse raffiniert. Aber auch die Erzeugung von Chlor, Natronlauge und (zukünftig) Wasserstoff wird durch Elektrolyse bewerkstelligt.
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
Objektträger, zwei Graphitelektroden, Klebeband, Pipette, Netzgerät, ph-Indikator
Chemikalien
Kupfersulfat Pentahydrat
Durchführung
Aus 2,5 g Kupfersulfat Pentahydrat und 10 mL dest. Wasser wird eine in etwa 1 molare Lösung hergestellt.
Auf einem Objektträger werden zwei Graphitelektroden mit Klebeband befestigt, so dass ein Abstand von ungefähr 5 mm verbleibt. 0,5 mL Milliliter der eben bereiteten Kupfersulfatlösung werden in diesen Zwischenraum pipettiert.
Bei Anlegen einer Spannung von etwa 10 V und einer Stromstärke von 0,2 A für eine Dauer von 10 s entsteht an der Kathode (Minuspol) elementares Kupfer und an der Anode Schwefelsäure (durch Überspannung auch Wasserstoff).
Die Schwefelsäure lässt sich mit einem pH-Indikator wie Methylrot oder pH-Papier nachweisen.
Entsorgung
Anfallender Abfall muss auf Grund der entstehenden Kupferverbindungen im Gefäß für Schwermetallsalz-Lösungen entsorgt werden.
Erklärung
Bei Anlegen einer Spannung laufen folgende Reaktionen ab:
Kathode (-): Cu2+ + 2 e- -> Cu
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Hydrolyse von Saccharose + Fehling Probe
Wendet man die Fehling-Probe bei Saccharose an, führt dies zu keinem Farbumschlag, da diese ein nicht-reduzierender Zucker ist.
Durch Hydrolyse des Disaccharids mit verdünnter Salzsäure entstehen die beiden Monosaccharide Glucose und Fructose (beides reduzierende Zucker), was sich durch eine anschließende Probe nach Fehling veranschaulichen lässt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Wendet man die Fehling-Probe bei Saccharose an, führt dies zu keinem Farbumschlag, da diese ein nicht-reduzierender Zucker ist.
Durch Hydrolyse des Disaccharids mit verdünnter Salzsäure entstehen die beiden Monosaccharide Glucose und Fructose (beides reduzierende Zucker), was sich durch eine anschließende Probe nach Fehling veranschaulichen lässt.
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
2 Reagenzgläser, Stativmaterial mit 2 Klemmen, Brenner oder Magnetrührer mit Becherglas, Pasteurpipetten
Chemikalien
Saccharose
Salzsäure (konz.)
Fehling I
Fehling II
Durchführung
Zur Demonstration werden beide Reagenzgläser nebeneinander aufgebaut und in diese je ein Spatel Saccarose sowie 1 ml heißes Wasser gegeben. Folgend wird einer der beiden Lösungen ein Tropfen konz. Salzsäure hinzugefügt.
Nach einer Wartezeit von 5 min werden in beide Regenzgläser je die gleichen Mengen an Fehling I und Fehling II pipettiert (ca. 2ml).
Anschließend werden beide Reagenzgläser mit einem Brenner (oder in einem Wasserbad unter Verwendung eines Magnetrührers) vorsichtig erwärmt. Jene zuvor mit Salzsäure behandelte Lösung führt zu einem Farbumschlag – die Fehling Probe ist positiv.
Entsorgung
Anfallender Abfall muss auf Grund der entstehenden Kupferverbindungen im Gefäß für Schwermetallsalz-Lösungen entsorgt werden.
Erklärung
Saccharose ist ein Disaccharid, welches aus den Monosacchariden Glucose und Fructose aufgebaut ist, die über eine α,β-1,2-glycosidische Bindung verbunden sind,. Saccharose selbst ist ein nicht reduzierender Zucker, sowohl Glucose als auch Fructose besitzen diese Eigenschaft.
Die Reaktion mit Wasser und katalytisch wirkender Salzsäure spaltet das Disaccharid in Glucose und Fructose auf, wodurch die Fehling-Probe positiv ausfällt.
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Merck)
Kaliumnatriumtartrat (kein Gefahrstoff nach GHS)
Saccharose (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Nachweis der Standardanionen im Trennungsgang
Im Trennungsgang liegen die Kationen als Salze der Standardanionen (Carbonat, Chlorid, Nitrat und Sulfat) vor. In einem ersten Schritt gilt es diese zu bestimmen, dies soll anhand dieses Experiments demonstriert werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im Trennungsgang liegen die Kationen als Salze der Standardanionen (Carbonat, Chlorid, Nitrat und Sulfat) vor. In einem ersten Schritt gilt es diese zu bestimmen.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Reagenzgläser, Reagenzglasständer, Spatel, Pasteurpipetten
Chemikalien
Natriumchlorid
Kaliumnitrat
Magnesiumsulfat
Natriumcarbonat
Silbernitrat-Lösung (0,1 M)
Bariumchlorid-Lösung (0,1 M)
Bariumhydroxid-Lösung (ges.)
Salzsäure (konz.)
Lunges Reagenz I und II
Zinkpulver
Eisessig
Durchführung
Carbonat:
Eine kleine Menge Natriumcarbonat wird in einem Reagenzglas mit konz. Salzsäure versehen und ein mit Bariumhydroxid-Lösung befülltes Gährröhrchen aufgesetzt. Alternativ kann das entstehende Gas mit einer gebogenen Pasteurpipette in die Lösung eingeleitet werden. Bei Anwesenheit von Carbonat trübt sich das Barytwasser:
CO2 + Ba(OH)2 -> BaCO3 + H2O
Chlorid:
Ein Spatel Natriumchlorid wird in einem Reagenzglas vorgelegt und in etwas Wasser gelöst. Bei Zugabe von Silbernitratlösung entsteht ein weißer Niederschlag.
Nitrat:
Eine nitrathaltige Probenlösung wird mit Lunges Reagenz I und II versehen und mit Eisessig angesäuert. Bei Zugabe eines Körnchens Zink entsteht Wasserstoff in statu nascendi, welcher das Nitrat zu Nitrit reduziert und es wird ein violetter Azofarbstoff gebildet.
Sulfat:
Zur Bestimmung von Sulfat wird eine 0,1 M Bariumchlorid-Lösung zur Probenlösung hinzugetropft. Liegt Sulfat vor, kommt es zur Bildung eines weißen Niederschlags.
Anmerkung
Im Trennungsgang müssen die Standardanionen im Sodaauszug der Ursubstanz nachgewiesen werden, da manche Kationen die dargestellten Nachweisreaktionen stören. Lediglich der Nachweis von Carbonat erfolgt aus der Ursubstanz – der Sodaauszug ist immer carbonathaltig.
Entsorgung
Anfallender Abfall wird im Gefäß für Schwermetallsalz-Lösungen entsorgt.
Video
Literatur
Gerdes, Eberhard: Qualitative Anorganische Analyse - Ein Begleiter für Theorie und Praxis, 2. korr. u. überarb. Auflage 1. Nachdr. 2001, Springer Verlag Berlin
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Merck)
Natriumchlorid (kein Gefahrstoff nach GHS)
Magnesiumsulfat (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Fehling-Probe
Um Aldehydgruppen (-CHO) in reduzierenden Zuckern nachzuweisen bedient man sich gerne der nach Hermann Fehling benannten Fehling-Probe. Zwei Nachweisreagenzien führen zusammen mit Aldehydgruppen zu einem Farbumschlag.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Um Aldehydgruppen (-CHO) in reduzierenden Zuckern nachzuweisen bedient man sich gerne der nach Hermann Fehling benannten Fehling-Probe. Zwei Nachweisreagenzien führen zusammen mit Aldehydgruppen zu einem Farbumschlag.
Schwierigkeitsgrad
Schülerexperiment - einfach
Geräte
2 Bechergläser 250 ml, 1 Becherglas 400ml, 2 Reagenzgläser, Stativmaterial mit 2 Klemmen, Magnetrührer/Heizplatte
Chemikalien
Kupfersulfat-Pentahydrat
Kaliumnatriumtartrat
Natriumhydroxid
Glucose
Durchführung
Zu Beginn werden die beiden Lösungen hergestellt.
Fehling I
7 g Kupfersulfat-Pentahydrat werden in 100 ml Wasser gelöst.
Fehling II
35 g Kaliumnatriumtartrat werden gemeinsam mit 10 g Natriumhydroxid in 100 ml Wasser gelöst.
Fehling-Probe
Zur Demonstration des Nachweises werden zwei Regenzgläser nebeneinander eingespannt und in eines davon ein Spatel Glucose gegeben. Anschließend werden beiden Regenzgläsern je die gleichen Mengen an Fehling I und Fehling II hinzugegeben (ca. 2ml).
Folgend wird ein Becherglas mit Wasser auf einem Magnetrührer unter der Apparatur aufgebaut, und damit beide Reagenzgläser gelinde erwärmt.
Entsorgung
Anfallender Abfall muss auf Grund der entstehenden Kupferverbindungen im Gefäß für Schwermetallsalz-Lösungen entsorgt werden.
Erklärung
Die wässrige Lösung von Kupfer(II)-sulfat (Fehling I) bildet beim Zusammenschütten mit dem Kaliumnatriumtartrat und der Natronlauge der Fehling-II-Lösung einen tiefblauen Tartrato-Kupfer(II)-Komplex.
Bei nicht-reduzierenden Zuckern wie Saccharose kommt es jedoch zu keiner Niederschlagsbildung - die Lösung bleibt tiefblau.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Kaliumnatriumtartrat (kein Gefahrstoff nach GHS)
Glucose (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
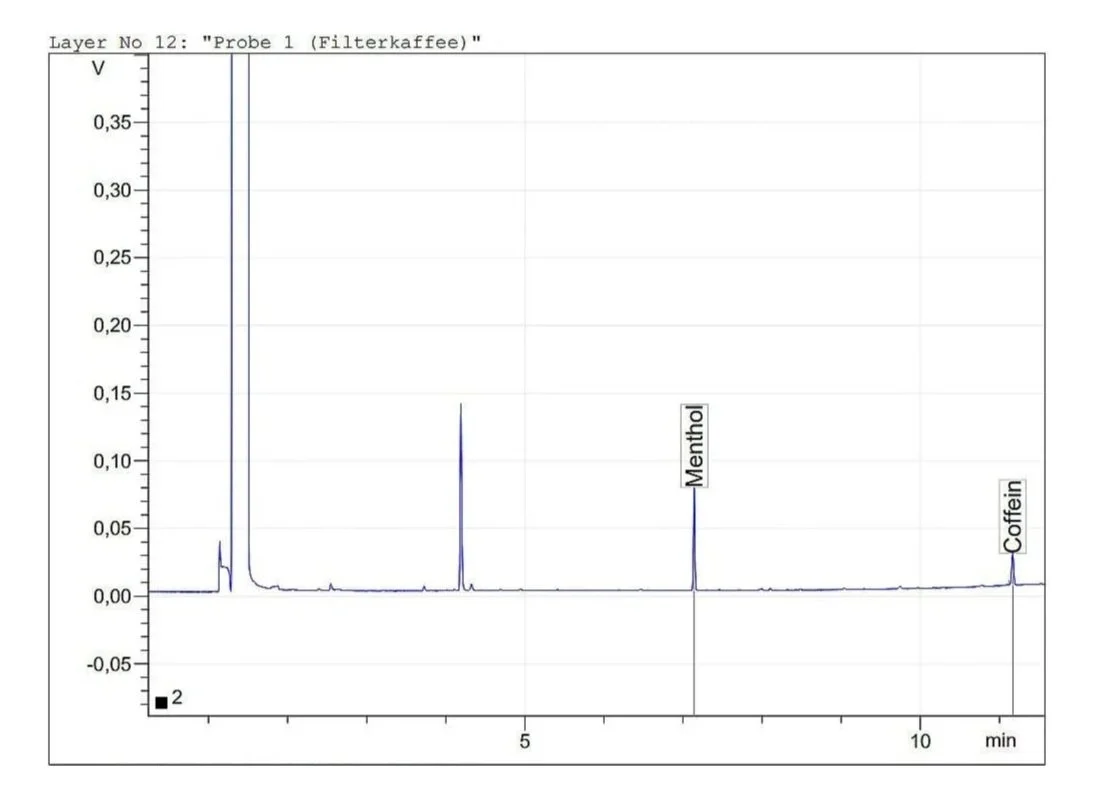
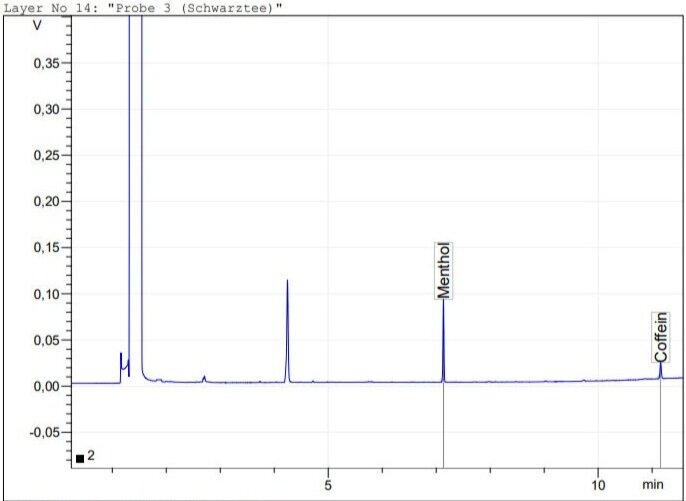
Gaschromatographische Bestimmung von Koffein in Kaffee und Tee
Es wird die Bestimmung des Koffeingehalts über GC-FID mit Menthol als interner Standard von Filterkaffee, Instant-Kaffee und Schwarztee beschrieben. Es wurden 0.47 mg/mL Koffein im Filterkaffee, 0.25 mg/mL im Instant-Kaffee und 0.13 mg/mL im Schwarztee gefunden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Es wird die Bestimmung des Koffeingehalts über GC-FID mit Menthol als interner Standard von Filterkaffee, Instant-Kaffee und Schwarztee beschrieben. Es wurden 0.47 mg/mL Koffein in Filterkaffee, 0.25 mg/mL in Instant-Kaffee und 0.13 mg/mL in Schwarztee gefunden.
Schwierigkeitsgrad
Schülerexperiment – schwer
Instrumentation und Messmethode
Alle Messungen wurden an einem HP 5890A GC-FID, ausgerüstet mit einer HP-5 Säule (5% Phenylmethylpolysiloxan, 25 m x 0,2 mm x 0,11 µm) und der Software Unichrom® durchgeführt. Die 1 µL Injektionen wurden manuell unter Verwendung einer Hamilton #95 5 µL Mikroliterspritze durchgeführt.
Die Messbedingungen waren: Ofentemperatur bei 50 °C für 2 min, dann 25 °C/min bis 275 °C für 1 min. Inlet/Detektor waren bei 275 bzw. 300 °C. Der Säulenvordruck von 4 PSI ergab einen Fluss von 1 mL/min Wasserstoff, woraus sich bei 3 mL/min Septum Purge und 30 mL/min Split Vent Flow ein Split-Verhältnis von 30:1 ergibt.
Geräte
25 mL und 10 mL Messkolben mit Stopfen, diverse Mess- und Vollpipetten, Pasteurpipetten, Vials, Analysenwaage, Mikrospatel
Chemikalien
Aceton (GC-FID/ECD grade)
Menthol (p.a.)
Koffein (p.a.)
Durchführung
Probenvorbereitung und Peak-Identifizierung
Es wurden 50.0 mg Koffein und 12.5 mg Menthol in je einen 25 mL Messkolben eingewogen und mit Aceton bis zur Eichmarke aufgefüllt. Durch Messung dieser beiden Standard-Lösungen ergaben sich folgende Retentionszeiten:
Menthol: 7.14 min
Koffein: 11.17 min
1.0 mL Filterkaffe (4 EL Kaffeepulver auf 10 Tassen Wasser) und 2.0 mL Instant-Kaffee (1 TL auf 220 mL Wasser) bzw. Schwarztee (1 Teebeutel auf 220 mL Wasser, 8 min Ziehzeit) wurden in je einen 10 mL Messkolben zusammen mit 1 mL der Menthol-Lösung pipettiert und mit Aceton bis zur Eichmarke aufgefüllt.
Quantifizierung
Chromatogramme
Filterkaffee
Instant-Kaffee
Schwarztee
Entsorgung
Alle Lösungen wurden als wässriger, halogenfreier Abfall entsorgt.
Ergebnis und Diskussion
Durch Berücksichtigung der vorhergehenden Verdünnung ergab sich für Filterkaffee ein Gehalt von 0.47 mg/mL Koffein, für Instant-Kaffee 0.25 mg/mL und für Schwarztee 0.13 mg/mL. Diese Werte liegen in dem durch Literaturrecherche ermittelten Erwartungsbereich. Die tatsächliche Menge an Koffein in derartigen Produkten variiert natürlich stark mit der jeweiligen Zubereitung.
Foto
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Beilstein-Probe
Die nach Friedrich Konrad Beilstein benannte Beilstein-Probe ist ein Verfahren der analytischen Chemie, um Verbindungen auf Halogene zu testen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die nach Friedrich Konrad Beilstein benannte Beilstein-Probe ist ein Verfahren der analytischen Chemie, um Verbindungen auf Halogene zu testen.
Schwierigkeitsgrad
Schülerexperiment – mittel
Geräte
Bunsenbrenner, Pinzette
Chemikalien
Stück Kupferblech/Kupferdraht
Halogenhaltige Probe (z.B. Chloroform)
Hinweis
Ausführung ausschließlich in einem gut ziehenden Abzug!
Durchführung
Mit Hilfe der Pinzette wird ein Stück eines Kupferblechs oder Kupferdrahtes in der nicht leuchtenden Bunsenbrenner-Flamme ausgeglüht. Nach kurzer Abkühlzeit wird das Kupfer in die Probensubstanz gehalten und erneut in der Flamme erhitzt. Hierfür kann Dichlormethan bzw. Chloroform aber z.B. auch PVC verwendet werden. Beim Vorhandensein von halogenhaltigen Verbindungen entsteht eine grüne Flammenfärbung. Für einen zuverlässigen Nachweis empfiehlt sich die Verwendung einer Blindprobe.
Entsorgung
Das gut ausgeglühte Kupfer kann im Hausmüll entsorgt werden.
Erklärung
Bei der Pyrolyse zersetzen sich die organischen Halogenverbindungen und bilden dabei beispielsweise Chlorwasserstoff oder Bromwasserstoff. Diese bilden mit Kupfer leicht flüchtige Kupfer-Halogen-Verbindungen, die zur Flammenfärbung führen.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Hölle des Gummibärchens
Bei diesem eindrucksvollen Versuch handelt es sich um ein Demonstrationsexperiment zu Redox-Reaktionen. Ein Gummibärchen wird in geschmolzenes Kaliumchlorat gegeben - es kommt zu einer heftigen Flammenbildung unter Rauch- und Geräuschentwicklung.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bei diesem eindrucksvollen Versuch handelt es sich um ein Demonstrationsexperiment zu Redox-Reaktionen. Ein Gummibärchen wird in geschmolzenes Kaliumchlorat gegeben - es kommt zu einer heftigen Flammenbildung unter Rauch- und Geräuschentwicklung.
Schwierigkeitsgrad
Demonstrationsexperiment – mittel
Geräte
Reagenzglas, Stativ, Bunsenbrenner, Gummibärchen, Pinzette
Chemikalien
Kaliumchlorat
Hinweis
Kaliumchlorat kann mit Reduktionsmitteln explosiv reagieren. Unter dem Reagenzglas ist eine feuerfeste Unterlage zu platzieren.
Durchführung
Ein schräg im Stativ eingespanntes Reagenzglas wird mit 3 Spateln reinem Kaliumchlorat befüllt und dieses anschließend mit dem Bunsenbrenner unter größter Vorsicht geschmolzen. Nun wird mit Hilfe der Pinzette ein Gummibärchen in das Reagenzglas gegeben. Das Gummibrächen verbrennt in einer mehrere Sekunden dauernden Reaktion beinahe vollständig.
Entsorgung
Die Reste sind im Feststoffabfall zu entsorgen.
Erklärung
Der im Zucker des Gummibärchen enthaltene Kohlenstoff wird in einer heftigen exothermen Reaktion zu Kohlenstoffdioxid oxidiert.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Biuret-Probe
Die Biuret-Reaktion dient als Nachweisreaktion für Proteine. Kupfer(II)sulfat reagiert dabei mit den Peptidbindungen zu einem violetten Komplex.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Biuret-Reaktion dient als Nachweisreaktion für Proteine. Kupfer(II)sulfat reagiert dabei mit den Peptidbindungen zu einem violetten Komplex.
Schwierigkeitsgrad
Schülerexperiment -einfach
Geräte
Reagenzglas, Pasteurpipette, Spatel, Reagenzglasständer
Chemikalien
Gelatine
Kupfer(II)sulfat
Natronlauge (10%)
Durchführung
In einem Reagenzglas wird ein Spatel Gelatine vorgelegt, welche in etwas destilliertem Wasser supsendiert wird. Anschließend werden einige Tropfen 10% Natronlauge hinzugegeben und der Inhalt des Reagenzglases gut gemischt. Darauffolgend wird zuvor bereitete, gesättigte Kupfer(II)sulfat-Lösung hinzugegeben, woraufhin ein Farbumschlag von blau nach violett zu sehen ist.
Entsorgung
Wässriger Schwermetallabfall.
Erklärung
Kupfer geht mit den freien Elektronenpaaren der Stickstoffatome aus den Aminosäuren eine koordinative Bindung ein. Es ändert sich dabei die Aufspaltung der d-Orbitale des Kupfers und die Farbe ändert sich von blau nach violett.
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Gelatine (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Xanthoprotein-Reaktion
Die Xanthoprotein-Reaktion dient als Nachweisreaktion für aromatische Aminosäuren in Proteinen. Sie ist somit spezifisch für die aromatischen Aminosäuren Phenylalanin, Tyrosin und Tryptophan.
Durch die Zugabe von Salpetersäure findet eine Nitrierung am Benzolring statt und es entsteht eine gelbliche Nitroverbindung.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Xanthoprotein-Reaktion dient als Nachweisreaktion für aromatische Aminosäuren in Proteinen. Sie ist somit spezifisch für die aromatischen Aminosäuren Phenylalanin, Tyrosin und Tryptophan.
Durch die Zugabe von Salpetersäure findet eine Nitrierung am Benzolring statt und es entsteht eine gelbliche Nitroverbindung.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Reagenzglas, Pasteurpipette, Spatel
Chemikalien
Gelatine
Salpetersäure (konz.)
Durchführung
In einem Reagenzglas wird ein Spatel Gelatine vorgelegt. Anschließend werden einige Tropfen konz. Salpetersäure hinzugegeben und mit einem Spatel umgerührt.
Entsorgung
Neutralisiert über das Abwasser.
Erklärung
Bei der Zugabe von Salpetersäure findet eine Nitrierung am Benzolring von aromatischen Aminosäuren statt, wobei eine gelbe Nitroverbindung entsteht.
Dabei wird ein Wasserstoffatom durch die Nitrogruppe der Salpetersäure substituiert:
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Gelatine (kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Synthese von Salicylsäuremethylester
Salicylsäuremethylester oder auch Wintergrünöl ist der Methylester der Salicylsäure. Es wird von vielen Pflanzen produziert und unteranderem als ätherisches Öl in Salben oder– vor allem in Nordamerika – als Geschmacksrichtung von Kaugummis eingesetzt. In diesem kurzen Experiment wird Methylsalicylat durch die Veresterung von Salicylsäure mit Methanol gewonnen, wobei Schwefelsäure als Katalysator verwendet wird. Aus vorher geruchsneutralen Edukten entsteht ein Produkt mit stark ausgeprägtem Geruch.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Salicylsäuremethylester oder auch Wintergrünöl ist der Methylester der Salicylsäure. Er wird von vielen Pflanzen produziert und unteranderem als ätherisches Öl in Salben oder– vor allem in Nordamerika – als Geschmacksrichtung von Kaugummis eingesetzt. In diesem kurzen Experiment wird Methylsalicylat durch die Veresterung von Salicylsäure mit Methanol gewonnen, wobei Schwefelsäure als Katalysator verwendet wird. Aus vorher geruchsneutralen Edukten entsteht ein Produkt mit stark ausgeprägtem Geruch.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Reagenzglas, Becherglas, Heizplatte
Chemikalien
Salicylsäure
Methanol
Schwefelsäure (konz.)
Durchführung
In einem Reagenzglas wird, da es sich um eine Gleichgewichtsreaktion handelt, 1g Salicylsäure mit 10 Äquivalenten Methanol (3 mL) zusammen mit wenigen Tropfen konz. Schwefelsäure bei ca. 80° C im Wasserbad für zehn Minuten erhitzt. Anschließend wird der Geruch vorsichtig (!) geprüft.
Entsorgung
Neutralisiert im organischen Lösungsmittelabfall.
Erklärung
Ester entstehen bei Mischung eines Alkohols mit einer Carbonsäure unter Anwesenheit eines Katalysators. Die dabei ablaufende Additions-Eliminierungs-Reaktion wird auch „Fischer-Veresterung“ genannt.
Im ersten Schritt wird die Salicylsäure durch die Schwefelsäure protoniert, wobei in weiterer Folge ein Carbeniumion gebildet wird - dadurch kann der Alkohol nukleophil angreifen. Das entstehende Intermediat widerspricht der Erlenmeyerregel, wodurch nach Protonenumlagerung Wasser abgespalten wird. Nach Deprotonierung – wobei der Katalysator regeneriert wird – entsteht Salicylsäuremethylester.
Fotos
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Elektrophile Addition
Bei der elektrophilen Addition reagieren ungesättigte Verbindungen wie Alkene oder Alkine mit unterschiedlichen Stoffklassen. So reagiert z.B. Cyclohexen mit Brom nach diesem Mechanismus, während Cyclohexan in einer radikalischen Substitution bromiert wird.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bei der elektrophilen Addition reagieren ungesättigte Verbindungen wie Alkene oder Alkine mit unterschiedlichen Stoffklassen. So reagiert z.B. Cyclohexen mit Brom nach diesem Mechanismus, während Cyclohexan in einer radikalischen Substitution bromiert wird (ein Experiment dazu haben wir bereits hier veröffentlicht).
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Reagenzgläser, Pasteurpipetten, Stopfen, Alufolie
Chemikalien
Cyclohexen
Bromwasser (2%)
Hinweise
Ausführung im Abzug! Niemals Brom mit Aceton mischen.
Durchführung
Es werden zwei Reagenzgläser mit je einer Pasteurpipette Cyclohexen in einen Reagenzglasständer gestellt, wobei eines der beiden Reagenzgläser mit Alufolie ummantelt ist, um den Inhalt vor Licht zu schützen. Dann wird jeweils eine Pasteurpipette 2 % Bromwasser hinzugegeben, beide Reagenzgläser mit einem Stopfen verschlossen und geschüttelt, wobei sich das Gemisch sofort entfärbt.
Wird die Alufolie entfernt, so kommt zum Vorschein, dass auch hier alles Brom reagierte. Die Reaktion ist also im Gegensatz zur radikalischen Substitution nicht von Licht abhängig.
Entsorgung
Um überschüssiges Brom zu quenchen, wird basische Natriumthiosulfatlösung hinzugegeben und der Inhalt beider Reagenzgläser als organischer, halogenhaltiger Abfall entsorgt.
Erklärung
Im ersten Schritt greift die Doppelbindung das Brom an, wodurch unter heterolytischer Spaltung ein Bromonium-Ion gebildet wird. Das dabei ebenfalls entstehende Halogenanion greift dann nukleophil das positivierte Kohlenstoffatom von der Rückseite an. Dabei wird gesättigtes trans-1,2-Dibromcyclohexan gebildet.
Video
Literatur
Kapeller/Koch: Chemische Experimente zur Organischen Chemie und zum Umweltschutz.
J. Clayden, et. al.: Organic Chemistry. 2012. Oxford University Press.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Radikalische Substitution
Bei der radikalischen Substitution, einem Reaktionsmechanismus der organischen Chemie, wird ein, an ein sp3-hybridisertes Kohlenstoffatom gebundenes Wasserstoffatom durch z.B. ein Sauerstoff- oder Halogenatom ersetzt. Diese Reaktion läuft nur dann ab, wenn Radikale durch homolytische Spaltung einer Bindung entstehen. Dies kann durch Radikalstarter (AIBN bzw. DBPO) oder bei Halogenen durch (UV-)Licht geschehen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bei der radikalischen Substitution, einem Reaktionsmechanismus der organischen Chemie, wird ein, an ein sp3-hybridisertes Kohlenstoffatom gebundenes Wasserstoffatom durch z.B. ein Sauerstoff- oder Halogenatom ersetzt. Diese Reaktion läuft nur dann ab, wenn Radikale durch homolytische Spaltung einer Bindung entstehen. Dies kann durch Radikalstarter (AIBN bzw. DBPO) oder bei Halogenen durch (UV-)Licht geschehen.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Reagenzgläser, Pasteurpipetten, Stopfen, Alufolie, Lichtquelle
Chemikalien
Cyclohexan
Bromwasser (2%)
Hinweise
Ausführung im Abzug! Niemals Brom mit Aceton mischen.
Durchführung
Es werden zwei Reagenzgläser mit je einer Pasteurpipette Cyclohexan in einen Reagenzglasständer gestellt, wobei eines der beiden Reagenzgläser mit Alufolie ummantelt ist, um den Inhalt vor Licht zu schützen. Dann wird jeweils eine Pasteupipette 2 % Bromwasser hinzugegeben, beide Reagenzgläser mit einem Stopfen verschlossen und geschüttelt. Dabei geht das Brom in die organische Phase über.
Um die Reaktion zu starten, wird das nicht ummantelte Reagenzglas Licht ausgesetzt. Dabei eignet sich entweder direktes Sonnenlicht, ein Overhead-Projektor oder eine 500 W Lampe.
Nach 10 min ist er Inhalt farblos – sämtliches Brom ist abreagiert. Bei dem vor Licht geschützten Reagenzglas ist das Cyclohexan weiterhin durch unreagiertes Brom rötlich gefärbt.
Entsorgung
Um überschüssiges Brom zu quenchen, wird basische Natriumthiosulfatlösung hinzugegeben und der Inhalt beider Reagenzgläser als organischer, halogenhaltiger Abfall entsorgt.
Erklärung
Im ersten Schritt wird ein sehr kleiner Teil des Broms durch UV-Licht homolytisch zu Bromradikalen gespalten. Da die Bindung von Brom mit 193 kJ/mol am schwächsten ist (C-H: 413 kJ/mol, C-C: 348 kJ/mol), wird diese Bindung gespalten.
Dann tritt eine Kettenreaktion auf: Für jedes reagierte Bromradikal entsteht ein neues Radikal.
Wenn sich zwei Radikale treffen, wird eine neue Bindung ausgebildet. Das ist aber unwahrscheinlich, da immer nur sehr wenig Radikale gleichzeitig vorliegen. Die Kettenreaktion läuft ca. 106 mal ab, bevor zwei Radikale aufeinander treffen und die Termination eintritt. Deshalb können manche radikalischen Reaktionen explosionsartig ablaufen (Z.B. die Reaktion von Chlorgas mit Wasserstoff).
Ohne UV-Licht startet die Reaktion nicht, weil keine Initiation stattfindet. Das ist an dem von vor Licht geschütztem Reagenzglas zu sehen.
Fotos
Video
Literatur
Kapeller/Koch: Chemische Experimente zur Organischen Chemie und zum Umweltschutz.
J. Clayden, et. al.: Organic Chemistry. 2012. Oxford University Press.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.