Gaschromatographische Bestimmung von Koffein in Kaffee und Tee
Es wird die Bestimmung des Koffeingehalts über GC-FID mit Menthol als interner Standard von Filterkaffee, Instant-Kaffee und Schwarztee beschrieben. Es wurden 0.47 mg/mL Koffein im Filterkaffee, 0.25 mg/mL im Instant-Kaffee und 0.13 mg/mL im Schwarztee gefunden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Es wird die Bestimmung des Koffeingehalts über GC-FID mit Menthol als interner Standard von Filterkaffee, Instant-Kaffee und Schwarztee beschrieben. Es wurden 0.47 mg/mL Koffein in Filterkaffee, 0.25 mg/mL in Instant-Kaffee und 0.13 mg/mL in Schwarztee gefunden.
Schwierigkeitsgrad
Schülerexperiment – schwer
Instrumentation und Messmethode
Alle Messungen wurden an einem HP 5890A GC-FID, ausgerüstet mit einer HP-5 Säule (5% Phenylmethylpolysiloxan, 25 m x 0,2 mm x 0,11 µm) und der Software Unichrom® durchgeführt. Die 1 µL Injektionen wurden manuell unter Verwendung einer Hamilton #95 5 µL Mikroliterspritze durchgeführt.
Die Messbedingungen waren: Ofentemperatur bei 50 °C für 2 min, dann 25 °C/min bis 275 °C für 1 min. Inlet/Detektor waren bei 275 bzw. 300 °C. Der Säulenvordruck von 4 PSI ergab einen Fluss von 1 mL/min Wasserstoff, woraus sich bei 3 mL/min Septum Purge und 30 mL/min Split Vent Flow ein Split-Verhältnis von 30:1 ergibt.
Geräte
25 mL und 10 mL Messkolben mit Stopfen, diverse Mess- und Vollpipetten, Pasteurpipetten, Vials, Analysenwaage, Mikrospatel
Chemikalien
Aceton (GC-FID/ECD grade)
Menthol (p.a.)
Koffein (p.a.)
Durchführung
Probenvorbereitung und Peak-Identifizierung
Es wurden 50.0 mg Koffein und 12.5 mg Menthol in je einen 25 mL Messkolben eingewogen und mit Aceton bis zur Eichmarke aufgefüllt. Durch Messung dieser beiden Standard-Lösungen ergaben sich folgende Retentionszeiten:
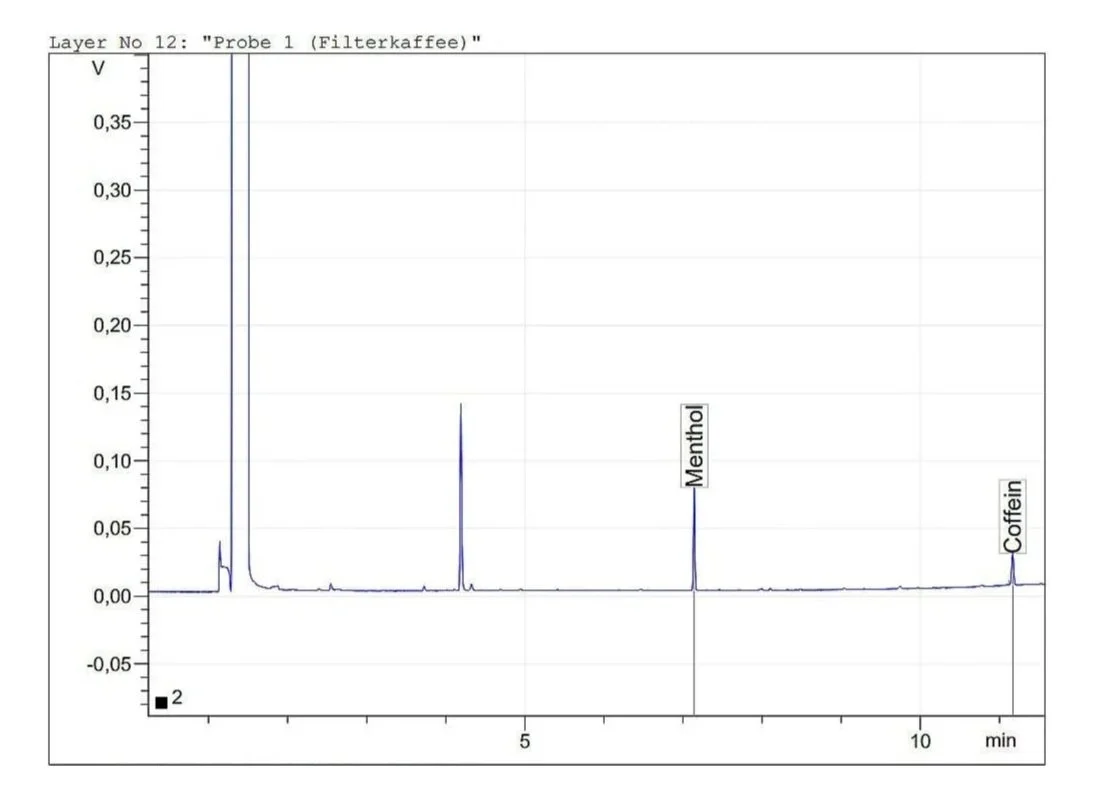
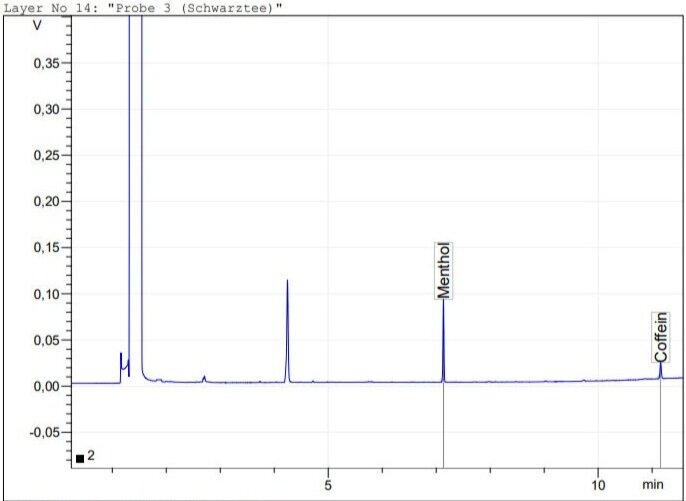
Menthol: 7.14 min
Koffein: 11.17 min
1.0 mL Filterkaffe (4 EL Kaffeepulver auf 10 Tassen Wasser) und 2.0 mL Instant-Kaffee (1 TL auf 220 mL Wasser) bzw. Schwarztee (1 Teebeutel auf 220 mL Wasser, 8 min Ziehzeit) wurden in je einen 10 mL Messkolben zusammen mit 1 mL der Menthol-Lösung pipettiert und mit Aceton bis zur Eichmarke aufgefüllt.
Quantifizierung
Chromatogramme
Filterkaffee
Instant-Kaffee
Schwarztee
Entsorgung
Alle Lösungen wurden als wässriger, halogenfreier Abfall entsorgt.
Ergebnis und Diskussion
Durch Berücksichtigung der vorhergehenden Verdünnung ergab sich für Filterkaffee ein Gehalt von 0.47 mg/mL Koffein, für Instant-Kaffee 0.25 mg/mL und für Schwarztee 0.13 mg/mL. Diese Werte liegen in dem durch Literaturrecherche ermittelten Erwartungsbereich. Die tatsächliche Menge an Koffein in derartigen Produkten variiert natürlich stark mit der jeweiligen Zubereitung.
Foto
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Beilstein-Probe
Die nach Friedrich Konrad Beilstein benannte Beilstein-Probe ist ein Verfahren der analytischen Chemie, um Verbindungen auf Halogene zu testen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die nach Friedrich Konrad Beilstein benannte Beilstein-Probe ist ein Verfahren der analytischen Chemie, um Verbindungen auf Halogene zu testen.
Schwierigkeitsgrad
Schülerexperiment – mittel
Geräte
Bunsenbrenner, Pinzette
Chemikalien
Stück Kupferblech/Kupferdraht
Halogenhaltige Probe (z.B. Chloroform)
Hinweis
Ausführung ausschließlich in einem gut ziehenden Abzug!
Durchführung
Mit Hilfe der Pinzette wird ein Stück eines Kupferblechs oder Kupferdrahtes in der nicht leuchtenden Bunsenbrenner-Flamme ausgeglüht. Nach kurzer Abkühlzeit wird das Kupfer in die Probensubstanz gehalten und erneut in der Flamme erhitzt. Hierfür kann Dichlormethan bzw. Chloroform aber z.B. auch PVC verwendet werden. Beim Vorhandensein von halogenhaltigen Verbindungen entsteht eine grüne Flammenfärbung. Für einen zuverlässigen Nachweis empfiehlt sich die Verwendung einer Blindprobe.
Entsorgung
Das gut ausgeglühte Kupfer kann im Hausmüll entsorgt werden.
Erklärung
Bei der Pyrolyse zersetzen sich die organischen Halogenverbindungen und bilden dabei beispielsweise Chlorwasserstoff oder Bromwasserstoff. Diese bilden mit Kupfer leicht flüchtige Kupfer-Halogen-Verbindungen, die zur Flammenfärbung führen.
Video
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Messung von Säure-/Base-Titrationskurven
Die Säure-/Base-Titration als Verfahren der quantitativen Analyse erlaubt die Bestimmung der Konzentration eines Analyten durch Verwendung einer Maßlösung bekannter Konzentration. Je nach verwendeter Säure (stark, schwach, mehrprotonig) ergeben sich charakteristische Titrationskurven und unterschiedliche Äquivalenzpunkte, die im folgenden Experiment gemessen werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Säure-/Base-Titration als Verfahren der quantitativen Analyse erlaubt die Bestimmung der Konzentration eines Analyten durch Verwendung einer Maßlösung bekannter Konzentration. Je nach verwendeter Säure (stark, schwach, mehrprotonig) ergeben sich charakteristische Titrationskurven und unterschiedliche Äquivalenzpunkte, die im folgenden Experiment gemessen werden.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
pH-Meter, Bürette, Stativmaterial, Magnetrührer mit Rührfisch, 25 mL Messkolben, Vollpipette
Chemikalien
konz. Salzsäure
konz. Phosphorsäure
Eisessig
Natriumhydroxid-Maßlösung (c = 1 mol/L)
Durchführung
2,5 mL konz. Salzsäure, 1,5 mL Eisessig und 1,7 mL konz. Phosphorsäure werden in je einem 25 mL Messkolben vorgelegt und bis zur Eichmarke mit dest. Wasser aufgefüllt. Dadurch ergeben sich ca. 1 M Lösungen. Liegt keine 1 M Natronlauge vor, so kann diese durch Lösen von 2,0 g Natriumhydroxid in 50 mL dest. Wasser hergestellt werden.
Nun werden jeweils 5 mL der Säure in ein Becherglas überführt und mit etwa 100 mL dest. Wasser verdünnt. Während in 0,1 – 1,5 mL Inkrementen Natronlauge durch die Bürette zugetropft wird, wird nach jeder Zugabe der pH-Wert gemessen.
Entsorgung
Alle Lösungen können stark verdünnt über das Abwasser entsorgt werden.
Erklärung
Je nach vorliegender Säure ergeben sich unterschiedliche Äquivalenzpunkte und Titrationskurven:
Salzsäure ist eine starke Säure und liegt in wässriger Lösung komplett dissoziiert vor.
Da entstehendes Kochsalz in Lösung pH-neutral ist, liegt der Äquivalenzpunkt genau bei pH 7.
Essigsäure ist eine schwache Säure: Der pH-Wert liegt am Anfang nicht so tief wie der von Salzsäure. Dieser steigt dann rasant bis in den Bereich, in dem die Pufferwirkung von Essigsäure/Acetat zu tragen kommt, an.
Da Natriumacetat als Salz einer schwachen Säure und starken Base leicht basisch ist, liegt der Äquivalenzpunkt nun nicht bei pH 7.
Phosphorsäure spaltet nicht alle drei Protonen sofort ab: Stattdessen gibt es zwei Äquivalenzpunkte und Stufen in der Titrationskurve.
Bei dem Verdünnen mit Wasser geschieht folgendes:
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Leuchtprobe
Alle jene, die Chemie studiert haben, werden irgendwann mal mit dem berüchtigten Trennungsgang in Berührung gekommen sein. Besonders die Nachweisreaktionen - mal falsch-positiv, mal falsch-negativ - haben für viel Frustration gesorgt und ein kalter Aufschluss beim Assistenten funktionierte zumeist auch nicht. Ist man aber nicht gerade im stressigen Praktikum, können manche Nachweise sehr schön sein – so wie die hier dargestellte Leuchtprobe auf Zinn.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alle jene, die Chemie studiert haben, werden irgendwann mal mit dem berüchtigten Trennungsgang in Berührung gekommen sein. Besonders die Nachweisreaktionen - mal falsch-positiv, mal falsch-negativ - haben für viel Frustration gesorgt und ein kalter Aufschluss beim Assistenten funktionierte zumeist auch nicht. Ist man aber nicht gerade im stressigen Praktikum, können manche Nachweise sehr schön sein – so wie die hier dargestellte Leuchtprobe auf Zinn.
Schwierigkeitsgrad
Schülerexperiment - mittel
Geräte
Bunsenbrenner, Reagenzglasklemme, Reagenzglas, 50 mL Becherglas, Spatel, Feuerzeug
Chemikalien
Zink (entweder als Pulver oder Granalien)
konz. Salzsäure
30 % Wasserstoffperoxid (optional)
zinnhaltige Probe
Durchführung
Die zinnhaltige Probe wird mit etwas Zink in ein kleines Becherglas gegeben und mit konz. Salzsäure versehen. Liegt das Zinn metallisch vor, sollte zuerst mit Salzsäure/Wasserstoffperoxid aufgeschlossen werden (Vorsicht!) und diese Lösung verwendet werden.
Ein mit kaltem Wasser oder Eis befülltes Reagenzglas wird dann in die Lösung getaucht und in die oxidierende Flamme des Brenners gehalten. Bei Anwesenheit von Zinn ist eine blaue Lumineszenz erkennbar.
Entsorgung
Nach dem Abreagieren wird die Lösung als Schwermetallabfall entsorgt.
Erklärung
Zink und Salzsäure reagiert zu Wasserstoff in statu nascendi und Zinkchlorid.
Der frisch entstehende, noch atomare Wasserstoff ist ein starkes Reduktionsmittel. In der Probe enthaltenes Zinn reagiert mit naszierendem Wasserstoffgas unter Entstehung von Zinnhydrid.
Das Leuchten beruht hier auf der blauen Fluoreszenz durch Zinn-Ionen auf Grund thermischer Anregung durch die Brennerflamme.
Foto
Video
Literatur
Gerdes, E.: Qualitative Anorganische Analyse: Ein Begleiter für Theorie und Praxis. 2., korrigierte und überarbeitete Auflage. Heidelberg, Springer-Verlag Berlin Heidelberg GmbH. 2001.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chromatographie von Blattfarbstoffen
Im Herbst verfärben sich die Blätter sämtlicher Bäume und werden bunt. Doch wie kommt es eigentlich dazu? Um eine Erklärung zu finden, müssen die Blätter zuerst mit einem geeigneten Verfahren untersucht werden. Hierbei ist die Auftrennung und Analyse über eine Dünnschichtchromatographie am zweckmäßigsten, welche von Schülern problemlos selbst durchgeführt werden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im Herbst verfärben sich die Blätter sämtlicher Bäume und werden bunt. Doch wie kommt es eigentlich dazu? Um eine Erklärung zu finden, müssen die Blätter zuerst mit geeigneten Verfahren untersucht werden. Hierbei ist die Auftrennung via Dünnschichtchromatographie und UV/VIS-Spektroskopie am zweckmäßigsten.
Schwierigkeitsgrad
Schülerexperiment, mittel
Geräte
Macherey-Nagel DC Platten ALUGRAM Sil G/UV254 5x7,5 cm, Mikroliterpipette 1-5 µl mit passenden Spitzen, Schraubdeckelglas, Reibschale mit Pistill, Quarzsand, Faltenfilter, Pasteurpipette, Reagenzglas und Reagenzglasständer, Messpipetten, Bleistift und Geodreieck, Pinzette, UV/VIS-Spektrometer, PS Küvetten
Chemikalien
Ethanol
Ethylacetat
Cyclohexan
Hinweis
DC Platten niemals ohne Handschuhe angreifen, da Feuchtigkeit die Trennleistung mindert. Kurzwelliges UV-Licht ist für die Augen sehr schädlich!
Durchführung
Vorbereitung:
Zuerst wird das Probenmaterial besorgt: Das können z.B. Blätter von Bäumen sein. Stehen diese nicht zur Verfügung, eignet sich auch eingefrorener Spinat hervorragend für dieses Experiment.
Das pflanzliche Material wird dann im Mörser mit etwas Sand versehen und vollständig mit Ethanol bedeckt. Durch Zerreiben werden die Pflanzenfarbstoffe rasch extrahiert und der Ethanol nimmt eine intensiv-grüne Farbe an. Durch Filtration über einen Faltenfilter werden alle störenden Schwebstoffe entfernt. Insbesondere für die UV/VIS-Spektroskopie muss die Probenlösung klar sein.
Dünnschichtchromatographie:
Für die Dünnschichtchromatographie muss zuerst das Laufmittel hergestellt werden: Dazu wird Cyclohexan und Ethylacetat im Verhältnis 3:1 gemischt. Für ein handelsübliches 450 g Marmeladenglas – das als Entwicklungskammer zweckentfremdet wird - sind ca. 10-15 mL Laufmittel notwendig. Es werden also zuerst 9 mL Cyclohexan gefolgt von 3 mL Ethylacetat in das Glas pipettiert und durch Schwenken vermischt. Um die Kammer mit Dampf zu sättigen, werden die Wände mit Küchenpapier ausgekleidet. Durch den Kontakt mit dem Laufmittel haften diese von selbst am Glas.
Während sich die Kammer äquilibriert, wird die DC Platte vorbereitet. Dazu wird 1 cm über dem unteren Rand der DC Platte unter Zuhilfenahme eines Geodreiecks ein gerader Strich mit einem weichen Bleistift gezeichnet. Auf dieser Hilfslinie werden dann mittels Mikroliterpipette 3x 5 µl Blattextrakt aufgetragen. Zwischen den Intervallen muss die Platte kurz trocknen, ansonsten breiten sich die Substanzflecken zu weit aus. Das Ziel ist, Substanzflecken in der Größe von 2-3 mm zu haben, um eine optimale Trennung zu gewährleisten. Es funktioniert sehr gut, mehrere Substanzflecken aneinander zu setzen, so dass die Auftragungszone entlang der Hilfslinie größer wird. Die Kieselgel-Schicht darf während des Auftragens nicht beschädigt werden.
Die betüpfelte DC Platte wird aufrecht in die Entwicklungskammer gestellt. Durch Kapillarkräfte steigt das Laufmittel entlang der Platte nach oben. Ist die Laufmittelfront nach 5-10 min ca. 1 cm vom oberen Rand entfernt, wird die DC-Platte mit einer Pinzette aus der Kammer genommen und die Laufmittelfront eingezeichnet, um später den Rf-Wert zu berechnen.
Die luftgetrocknete DC-Platte kann nun unter kurzwelligem (254 nm) und langwelligem (366 nm) UV-Licht betrachtet werden. Auf der DC-Platte befindet sich ein Fluoreszenzindikator, der unter kurzwelligem UV-Licht grün fluoresziert. Durch Fluoreszenzlöschung erscheinen Substanzflecken dunkel. Unter langwelligem UV-Licht besitzen manche Farbstoffe selbst eine Fluoreszenz. Auch die Betrachtung unter sichtbarem Licht eignet sich bei farbigen Substanzen.
Der Rf-Wert wird nach folgender Formel berechnet:
Rf = Laufstrecke Substanz / Abstand Auftragunglinie zur Laufmittelfront
UV/VIS-Spektroskopie:
Die Probenlösung wird mit einer Pasteurpipette in eine Küvette aus Polystyrol überführt und im UV/VIS-Spektrometer gemessen.
Entsorgung
Alle Lösungsmittel kommen in den Behälter für organische, halogenfreie Abfälle.
Erklärung
Dünnschichtchromatographie:
Die mobile Phase – das Laufmittel - schleppt alle Farbstoffe mit. Diese haben aber aufgrund ihres unterschiedlichen Aufbaus unterschiedlich starke Wechselwirkungen mit der stationären Phase – dem Kieselgel. Manche Farbstoffe werden vom Kieselgel stärker zurückgehalten, andere schwächer. Das führt zu einem Trenneffekt und das zuvor homogene Gemisch kann in seien Bestandteile zerlegt und analysiert werden.
UV/VIS-Spektroskopie:
Im UV/VIS-Spektrometer wird Licht mit definierter Wellenlänge auf die Probe gestrahlt und mit einem Detektor gemessen, wie viel davon absorbiert wird. So absorbieren Chlorophyll A und B blaues und rotes Licht, reflektieren aber grünes Licht (weshalb wir Pflanzen als „grün“ wahrnehmen). Aber wie die Dünnschichtchromatographie gezeigt hat, besteht der Blattextrakt nicht nur aus grünem Chlorophyll – auch im UV/VIS-Spektrum kann das Absorbtionsmaximum von beta-Carotin bei 475 nm identifiziert werden.
Antwort auf die Eingangsfrage: Warum verfärben sich die Blätter im Herbst ?
Würde man ein Blatt aus dem Sommer und eines aus dem Herbst vergleichen, würde man sehen, dass die Rf-Werte gleichbleiben – also dieselben Substanzen im Blatt vorkommen. Was sich ändert, ist die Zusammensetzung. Grünes Chlorophyll wird im Herbst tiefer im Stamm eingelagert, orange und rote Carotinoide bzw. Xantophylle kommen dann zum Vorschein.
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Tollens-Test - Silberspiegel
Der Tollens-Test ist – wie die Fehling-Probe – eine sehr empfindliche Nachweismethode für Aldehyde oder andere reduzierend wirkende Verbindungen.
Aber es gibt auch eine andere Anwendung: Bevor man technisch in der Lage war, Oberflächen mit Metallen zu bedampfen, um Spiegel zu erzeugen, wurden diese mit Tollens-Reagenz verspiegelt. Christbaumkugeln werden auch heute noch so hergestellt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Der Tollens-Test ist – wie die Fehling-Probe – eine sehr empfindliche Nachweismethode für Aldehyde oder andere reduzierend wirkende Verbindungen.
Aber es gibt auch eine andere Anwendung: Bevor man technisch in der Lage war, Oberflächen mit Metallen zu bedampfen, um Spiegel zu erzeugen, wurden diese mit Tollens-Reagenz verspiegelt. Christbaumkugeln werden zum Teil auch heute noch so hergestellt.
Schwierigkeitsgrad
Schülerversuch - schwer
Geräte
sauberes (!) Reagenzglas, Reagenzglasständer, 100 mL Erlenmeyerkolben, Pasteurpipetten
Chemikalien
Silbernitratlösung 0,1 mol/L
konz. Salmiakgeist (25-30 %)
Natriumhydroxid
Glucose
Hinweis
Durchführung
In ein kleines Reagenzglas werden 2,5 mL 0,1 molare Silbernitratlösung gegeben. Hinzu kommen einige wenige Körnchen Natriumhydroxid. Die Lösung wird dann mit so viel konz. Salmiakgeist versetzt, bis sich der entstehende Niederschlag wieder auflöst (genau arbeiten, nicht zu viel hinzugeben). Dann werden 1,5 mL gesättigte Glucoselösung hinzugegeben und das Reagenzglas im Wasserbad bei 60-70 °C erwärmt. Es scheidet sich innerhalb von einer Minute elementares Silber an der Gefäßwand ab – es entsteht ein Silberspiegel. Das Reagenzglas wird zum Schluss dreimal mit dest. Wasser ausgewaschen – der Spiegel bleibt so über längere Zeit stabil.
Entsorgung
Das Waschwasser sowie die gebrauchte Verspiegelungslösung werden mit überschüssiger Glukose versetzt und so das gesamte Silber reduziert. Nach einem Tag filtriert man: Das Filtrat kommt gut verdünnt in den Abfluss, der Niederschlag in den Behälter für anorganische Schwermetallabfälle.
Erklärung
Da Salmiakgeist alkalisch ist, bildet sich Silber(I)oxid als Niederschlag.
Mit weiterem Salmiakgeist geht Silber(I)oxid in den löslichen Diamminsilber(I)-komplex über.
Bei Zugabe von Glucose (einer Aldose), wird die Aldehydgruppe zur Carbonsäure oxidiert, während der Silberkomplex zu elementarem Silber reduziert wird.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Carl Roth)
Glucose (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Schiffsche Probe (Aldehydnachweis)
Die Schiffsche Probe, benannt nach dem deutsch-italienischen Chemiker Hugo Schiff, ist eine Nachweisreaktion, die zum qualitativen Test auf Aldehyde verwendet wird. Obwohl die Schiff’sche Probe um 1860 entwickelt wurde, konnte erst über 120 Jahre später 1980 der ablaufende Reaktionsmechanismus mittels NMR-Spektroskopie geklärt werden. Außerdem findet Schiffs Reagenz, das für die Nachweisreaktion benötigt wird, auch in der Histologie als Färbemittel Einsatz.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Schiffsche Probe, benannt nach dem deutsch-italienischen Chemiker Hugo Schiff, ist eine Nachweisreaktion, die zum qualitativen Test auf Aldehyde verwendet wird. Obwohl die Schiffsche Probe um 1860 entwickelt wurde, konnte erst über 120 Jahre später 1980 der ablaufende Reaktionsmechanismus mittels NMR-Spektroskopie geklärt werden. Außerdem findet Schiffs Reagenz, das für die Nachweisreaktion benötigt wird, auch in der Histologie als Färbemittel Einsatz.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
2x Reagenzgläser oder 2x 25 mL Erlenmeyerkolben, 2x 50 mL Erlenmeyerkolben, Pasteur-Pipetten, Spatel, Trichter, Filterpapier, Analysenwaage, 1 mL Spritze oder Messpipette mit Pipettierhilfe
Chemikalien
Fuchsin
konz. 30% Salzsäure
Natriumsulfit (wasserfrei)
Aktivkohle
Probe
Hinweise
Fuchsin ist als vermutlich krebserzeugend eingestuft. Schüler dürfen mit diesem Stoff nicht experimentieren!
Ausführung im Abzug!
Durchführung
Herstellung von Schiffs Reagenz
0,025 g Fuchsin werden in einen 50 mL Erlenmeyerkolben eingewogen und in 25 mL dest. Wasser unter vorsichtigem Erwärmen auf dem Magnetrührer (40 °C) gelöst. Ein eventuell unlöslicher Rückstand wird durch Filtration entfernt. Zu der Fuchsinlösung werden 0,25 g wasserfreies Natriumsulfit hinzugefügt und mit 0,25 mL konz. Salzsäure angesäuert. Nach 30 min Standzeit wird die verbleibende Gelbfärbung mit etwas Aktivkohle entfernt und filtriert. Das so erhaltene Filtrat ist einsatzbereit und luft- bzw. lichtgeschützt lagerstabil.
Schiffsche Probe
1 mL der vermutlich aldehydhaltigen Probe wird mit 2 mL Schiffs Reagenz versehen. Der Nachweis ist positiv, wenn eine Violettfärbung eintritt.
Entsorgung
Schiffs Reagenz sowie die Probenlösung kommen in den Behälter für wässrige organische Abfälle.
Erklärung
Das zunächst violette Fuchsin reagiert mit in situ hergestellter Schwefeliger Säure zu farbloser Fuchsinschwefeliger Säure. Weil das Schwefel-Atom der Schwefeligen Säure an das zentrale Kohlenstoffatom des Fuchsins bindet, geht die sp2-Hybridisierung verloren und das zuvor große π-Elektronenfeld wird aufgespalten. Das Absorptionsmaximum verschiebt sich in den für den Menschen nicht sichtbaren Bereich und die Verbindung wird farblos.
Aldehyde reagieren dann mit den Aminogruppen der Fuchsinschwefeligen Säure zu einem Anlagerungsprodukt, wodurch der ursprüngliche sp2-Hybrid Zustand samt π-Elektronenfeld wiederhergestellt wird.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumsulfit (Kein gefährlicher Stoff nach GHS)
Aktivkohle (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.