Schiffsche Probe (Aldehydnachweis)
Die Schiffsche Probe, benannt nach dem deutsch-italienischen Chemiker Hugo Schiff, ist eine Nachweisreaktion, die zum qualitativen Test auf Aldehyde verwendet wird. Obwohl die Schiff’sche Probe um 1860 entwickelt wurde, konnte erst über 120 Jahre später 1980 der ablaufende Reaktionsmechanismus mittels NMR-Spektroskopie geklärt werden. Außerdem findet Schiffs Reagenz, das für die Nachweisreaktion benötigt wird, auch in der Histologie als Färbemittel Einsatz.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Schiffsche Probe, benannt nach dem deutsch-italienischen Chemiker Hugo Schiff, ist eine Nachweisreaktion, die zum qualitativen Test auf Aldehyde verwendet wird. Obwohl die Schiffsche Probe um 1860 entwickelt wurde, konnte erst über 120 Jahre später 1980 der ablaufende Reaktionsmechanismus mittels NMR-Spektroskopie geklärt werden. Außerdem findet Schiffs Reagenz, das für die Nachweisreaktion benötigt wird, auch in der Histologie als Färbemittel Einsatz.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
2x Reagenzgläser oder 2x 25 mL Erlenmeyerkolben, 2x 50 mL Erlenmeyerkolben, Pasteur-Pipetten, Spatel, Trichter, Filterpapier, Analysenwaage, 1 mL Spritze oder Messpipette mit Pipettierhilfe
Chemikalien
Fuchsin
konz. 30% Salzsäure
Natriumsulfit (wasserfrei)
Aktivkohle
Probe
Hinweise
Fuchsin ist als vermutlich krebserzeugend eingestuft. Schüler dürfen mit diesem Stoff nicht experimentieren!
Ausführung im Abzug!
Durchführung
Herstellung von Schiffs Reagenz
0,025 g Fuchsin werden in einen 50 mL Erlenmeyerkolben eingewogen und in 25 mL dest. Wasser unter vorsichtigem Erwärmen auf dem Magnetrührer (40 °C) gelöst. Ein eventuell unlöslicher Rückstand wird durch Filtration entfernt. Zu der Fuchsinlösung werden 0,25 g wasserfreies Natriumsulfit hinzugefügt und mit 0,25 mL konz. Salzsäure angesäuert. Nach 30 min Standzeit wird die verbleibende Gelbfärbung mit etwas Aktivkohle entfernt und filtriert. Das so erhaltene Filtrat ist einsatzbereit und luft- bzw. lichtgeschützt lagerstabil.
Schiffsche Probe
1 mL der vermutlich aldehydhaltigen Probe wird mit 2 mL Schiffs Reagenz versehen. Der Nachweis ist positiv, wenn eine Violettfärbung eintritt.
Entsorgung
Schiffs Reagenz sowie die Probenlösung kommen in den Behälter für wässrige organische Abfälle.
Erklärung
Das zunächst violette Fuchsin reagiert mit in situ hergestellter Schwefeliger Säure zu farbloser Fuchsinschwefeliger Säure. Weil das Schwefel-Atom der Schwefeligen Säure an das zentrale Kohlenstoffatom des Fuchsins bindet, geht die sp2-Hybridisierung verloren und das zuvor große π-Elektronenfeld wird aufgespalten. Das Absorptionsmaximum verschiebt sich in den für den Menschen nicht sichtbaren Bereich und die Verbindung wird farblos.
Aldehyde reagieren dann mit den Aminogruppen der Fuchsinschwefeligen Säure zu einem Anlagerungsprodukt, wodurch der ursprüngliche sp2-Hybrid Zustand samt π-Elektronenfeld wiederhergestellt wird.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumsulfit (Kein gefährlicher Stoff nach GHS)
Aktivkohle (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Katalytische Oxidation von Ethanol
Im menschlichen Körper wird Ethanol (Trinkalkohol) zu dem Zwischenprodukt Acetaldehyd mittels Enzymen umgewandelt - dies ist u.a. für den „Kater“ am nächsten Morgen verantwortlich. Im Labor ist die gezielte Oxidation von primären Alkoholen zu Aldehyden schwierig und nur mit speziellen Reaktionsbedingungen zu erreichen, da Aldehyde ebenfalls oxidationsempfindlich sind und zur Carbonsäure weiter reagieren.
Das folgende Experiment zeigt die katalytische Oxidation von Ethanol an heißem Kupfer-(II)-oxid zu Acetaldehyd.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im menschlichen Körper wird Ethanol (Trinkalkohol) zu dem Zwischenprodukt Acetaldehyd mittels Enzymen umgewandelt - dies ist u.a. für den „Kater“ am nächsten Morgen verantwortlich. Im Labor ist die gezielte Oxidation von primären Alkoholen zu Aldehyden schwierig und nur mit speziellen Reaktionsbedingungen zu erreichen, da Aldehyde ebenfalls oxidationsempfindlich sind und zur Carbonsäure weiter reagieren.
Das folgende Experiment zeigt die katalytische Oxidation von Ethanol an heißem Kupfer-(II)-oxid zu Acetaldehyd.
Schwierigkeitsgrad
Demonstrationsexperiment, mittel
Geräte
250 mL Becherglas, Magnetrührer mit Heizplatte, Kupferdraht, Bunsenbrenner, Pinzette, 400 mL Becherglas, Stativ
Chemikalien
Ethanol
Schiff’s Reagenz
Hinweise
Acetaldehyd ist als krebserzeugend (Kategorie 1B) eingestuft. Ausführung im Abzug!
Fuchsin steht im Verdacht krebserzeugend zu sein.
Durchführung
Ein 250 mL Becherglas wird 1 cm hoch mit Ethanol befüllt und auf 40-50°C am Magnetrührer erhitzt. Der Kupferdraht wird nun mittels Pinzette in der Brennerflamme bis zum Glühen erwärmt und dann knapp über die Ethanol-Oberfläche an einem Stativ aufgehängt.
Durch die exotherme Reaktion glüht der Draht auf. Außerdem erscheint der Draht abwechseln blank bzw. mit einer Oxidschicht überzogen.
Wird eine Probe des Ethanols nach der Reaktion mit Schiff’s Reagenz versetzt, fällt dieser Test positiv aus. Damit ist die Präsenz von Acetaldehyd nachgewiesen.
Anmerkung
Der Ethanol kann sich entzünden. Zum Löschen wird ein 400 mL Becherglas, welches in diesem Fall darübergestülpt wird, bereitgestellt.
Entsorgung
Ethanol im Abzug verdunsten lassen.
Schiff’s Reagenz wird als wässriger, organischer Abfall entsorgt.
Erklärung
Beim Zusammenkommen von Ethanoldampf und Kuper-(II)-oxid kommt es zu einer exothermen Redoxreaktion, da Kupfer-(II)oxid die Oxiation von Ethanol zu Acetaldehyd katalysiert:
Fotos
Video
Literatur
Asselborn, W., Jäckel, M. und Risch, K. T.; Chemie heute SII Gesamtband, Auflage A5, Schroedel Verlag, 2011, S. 316
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemolumineszenz von Luminol
Chemolumineszenz beschreibt das Phänomen, wenn die Energie, die bei einer Reaktion freigesetzt wird, nicht – wie sonst üblich – als Wärme, sondern in Form von Licht abgegeben wird. Am weitesten verbreitet ist die Peroxyoxalat-Reaktion: In kommerziell erhältlichen Knicklichtern wird ein Oxalsäureester mit einem Fluoreszenzfarbstoff und Wasserstoffperoxid zum Leuchten „angeregt“.
Auch die Luminol-Reaktion findet Anwendung: Es werden nämlich Eisen-Ionen für die Chemolumineszenz benötigt. Dadurch lassen sich in der Forensik geringste Mengen Blut nachweisen, die weder mit freiem Auge noch unter UV-Licht sichtbar wären.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
EINLEITUNG
Chemolumineszenz beschreibt das Phänomen, wenn die Energie, die bei einer Reaktion freigesetzt wird, nicht – wie sonst üblich – als Wärme, sondern in Form von Licht abgegeben wird. Am weitesten verbreitet ist die Peroxyoxalat-Reaktion: In kommerziell erhältlichen Knicklichtern wird ein Oxalsäureester mit einem Fluoreszenzfarbstoff und Wasserstoffperoxid zum Leuchten „angeregt“.
Auch die Luminol-Reaktion findet Anwendung: Es werden nämlich Eisen-Ionen für die Chemolumineszenz benötigt. Dadurch lassen sich in der Forensik geringste Mengen Blut nachweisen, die weder mit freiem Auge noch unter UV-Licht sichtbar wären.
SCHWIERIGKEITSGRAD
Demonstrationsexperiment - einfach
GERÄTE
2x 250 mL Becherglas, 1000 mL Erlenmeyerkolben, 25 mL Erlenmeyerkolben, 300 mm Schlangenkühler, 10 mL Messkolben, Magnetrührer, Rührfisch, Trichter, Stativ, Analysenwaage, Spatel, 2 mL Spritzen, Kanülen
CHEMIKALIEN
Luminol
Natriumhydroxid
30% Wasserstoffperoxid
Kaliumhexacyanoferrat (III)
Fluorescein
DURCHFÜHRUNG
In einen 10 mL Messkolben werden 1,0 g Natriumhydroxid eingewogen und mit dest. Wasser bis zur Eichmarke aufgefüllt.
In der Zwischenzeit wird ein Magnetrührer aufgebaut, auf dem sich ein 1000 mL Erlenmeyerkolben befindet. In ein Stativ wird ein Schlangenkühler so platziert, dass dessen unteres Ende in den Erlenmeyerkolben mündet und auf das obere Ende ein Trichter aufgesetzt.
Lösung I: Von dieser 10% Natriumhydroxid-Lösung werden nach dem Erkalten 1,25 mL in ein 250 mL Becherglas überführt, mit 98,75 mL Wasser verdünnt und darin 0,025 g Luminol gelöst.
Lösung II: 0,375 g Kaliumhexacyanoferrat (III) werden in 99,6 mL Wasser gelöst und 0,75 mL 30% Wasserstoffperoxid hinzugefügt.
Lösung III: Die übrige 10% Natronlauge (8,75 mL) wird mit ca. 200 mL dest. Wasser verdünnt und darin eine Spatelspitze Fluorescein gelöst.
Lösung III kommt dann in den Erlenmeyerkolben, während Lösung I + II langsam und gleichzeitig in den Trichter zusammengeschüttet werden. Sobald sich die Lösungen mischen, ist eine blaue Leuchterscheinung zu beobachten, während der Inhalt des Erlenmeyerkolbens allmählich beginnt grün zu leuchten (unbedingt Raum abdunkeln!).
ANMERKUNG
Es empfiehlt sich, das Wasserstoffperoxid und das Luminol zeitnah zum Experiment zu lösen, da diese Verbindungen gelöst nur eine begrenzte Lagerstabilität aufweisen.
Mit Rhodamin B ist eine violette, anstatt einer grünen Fluoreszenz zugänglich. Dies wurde aber nicht getestet.
ENTSORGUNG
Die Reaktionslösung wird mit einer Kochplatte auf rund 50 mL eingeengt und als anorganischer Schwermetallabfall entsorgt. Wird der Versuch öfters durchgeführt, kann die Reaktionslösung auch gesammelt werden und alles auf einmal eingeengt werden.
ERKLÄRUNG
Luminol wird durch das Natriumhydroxid zu einem Dianion deprotoniert und dieses mit Wasserstoffperoxid zum 3-Aminophthalat-Dianion unter Abgabe von Stickstoff oxidiert. Das Dianion ist dabei in einem angeregten Zustand und gibt beim Wechsel in den Grundzustand Energie in Form von Licht ab. Das Kaliumhexacyanoferrat dient als Katalysator und sorgt für eine höhere Intensität, verkürzt aber die Leuchtdauer. Der genaue Mechanismus der Oxidation ist noch unbekannt, es wird aber angenommen, dass die Oxidation durch ein Hyperoxidradikalion (O2-) ermöglicht wird – Kaliumhexacyanoferrat sollte die Freisetzung dieser Radikale aus dem Wasserstoffperoxid fördern.
FOTO
VIDEO
LITERATUR
GEFÄHRDUNGSBEURTEILUNG (GESTIS-STOFFDATENBANK, 2020)
Kaliumhexacyanoferrat III (Kein gefährlicher Stoff nach GHS)
Luminol (Kein gefährlicher Stoff nach GHS)
werbung
Silberbesteck zum Glänzen bringen
Beim Reinigen von Silberbesteck wurden ganze Generationen von Hausfrauen „verschlissen“. Die Arbeit war anstrengend und wegen der geringen Nachhaltigkeit auch deprimierend: Egal, wie gut das Silber geputzt wurde - nach kurzer Zeit läuft es wieder an. Der Inbegriff einer Sisyphus Arbeit! Doch Silber sollte ja eigentlich so edel sein… Glücklicherweise braucht man mit etwas chemischem Wissen und ein paar einfachen Hausmitteln nie wieder lange Silberbesteck polieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Beim Reinigen von Silberbesteck wurden ganze Generationen von Hausfrauen „verschlissen“. Die Arbeit war anstrengend und wegen der geringen Nachhaltigkeit auch deprimierend: Egal, wie gut das Silber geputzt wurde - nach kurzer Zeit läuft es wieder an. Der Inbegriff einer Sisyphus Arbeit!
Doch Silber sollte ja eigentlich so edel sein… Glücklicherweise braucht man mit etwas chemischem Wissen und ein paar einfachen Hausmitteln nie wieder lange Silberbesteck polieren.
Schwierigkeitsgrad
Experiment für zu Hause - einfach
Geräte
Angelaufenes Silberbesteck, Gefäß, Alufolie
Chemikalien
Natriumchlorid (Kochsalz)
Durchführung
Das Silberbesteck wird in ein Gefäß, welches Innen mit Alufolie ausgekleidet wurde, gelegt. Nun wird mit heißem Salzwasser (5EL Salz auf 1L Wasser) aufgefüllt, bis alle Silberteile bedeckt sind.
Unmittelbar danach sind kleine Luftbläschen erkennbar und die schwarze Schicht beginnt sich zu lösen. Nach 5 Minuten kann das Besteck herausgenommen und nach kurzem Abwaschen wieder verwendet werden.
Entsorgung
Alufolie im Restmüll entsorgen und die Salzlösung gut verdünnt dem Abwasser zuführen.
Erklärung
Das Redox-Gleichgewicht dieser Reaktion liegt stark auf der linken Seite, das Silber sollte also als Edelmetall aufgrund seines hohen Redoxpotentials gegen eine Oxidation durch Sauerstoff stabil sein.
Wenn jedoch ein Stoff wie Schwefelwasserstoff, der mit Silber-Ionen schwerlösliche Verbindungen eingeht, anwesend ist, kann auch Sauerstoff das Silber oxidieren, denn die Bildung der Sulfide setzt Energie frei. Somit sinkt das Redoxpotential des Silbers von 0,8 Volt auf ca. 0,1 Volt (Zinn: 0,136 Volt) – das Metall wird scheinbar unedler.
Sobald Silber also in Gegenwart von Luftsauerstoff mit Schwefelwasserstoff in Kontakt kommt (z.B. mit Eiern oder Erbsensuppe), „läuft“ das Silber an – es bildet sich eine verfärbte Schicht.
Durch Kontakt mit Aluminium in einer Elektrolyt-Lösung wird ein Lokalelement gebildet und dadurch der Silbersulfidbelag elektrochemisch wieder zu metallischem Silber reduziert.
Dabei wird wieder Schwefelwasserstoff frei, wodurch es unangenehm riechen kann.
Der Vorteil dieser chemischen Methode im Gegensatz zum mechanischen Reinigen liegt darin, dass kein Silber verloren geht.
Fotos
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Lumineszenz von Singulett-Sauerstoff
Sauerstoff ist das häufigste Element auf der gesamten Erde mit 32,4% Massenanteil. Das liegt daran, dass die meisten Metalle als oxidische Erze vorkommen. In unserem Sonnensystem ist es nach Wasserstoff und Helium das dritthäufigste Element - allerdings mit nur 0,8 %.
Sauerstoff kommt dabei als paramagnetischer Triplett-Sauerstoff vor. Es gibt aber noch eine andere, energiereichere Form des Sauerstoffs, den Singulett-Sauerstoff. Dieser ist äußerst kurzlebig (ca. 10-4 Sekunden) und wandelt sich in Triplett Sauerstoff um, wobei rotes Licht emittiert wird.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Sauerstoff ist das häufigste Element auf der gesamten Erde mit 32,4% Massenanteil. Das liegt daran, dass die meisten Metalle als oxidische Erze vorkommen. In unserem Sonnensystem ist es nach Wasserstoff und Helium das dritthäufigste Element - allerdings mit nur 0,8 %.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
500 mL Zweihalskolben, Tropftrichter mit Druckausgleich, Übergangsstück mit Schlaucholive, 250 mL Gaswaschflasche, PVC-Schlauch, Laborstativset, 250 mL Erlenmeyerkolben, 50 mL Erlenmeyerkolben, 50 mL Messzylinder, Waage, Spatel
Chemikalien
Kaliumpermanganat
30% Wasserstoffperoxid
Natriumhydroxid
konz. 32% Salzsäure
Hinweise
Für den Versuch muss ein sehr starker Chlorgasstrom erzeugt werden. Arbeiten im Abzug!
Durchführung
20g Natriumhydroxid werden in einem 250 mL Erlenmeyerkolben mit 140 mL Wasser versetzt und im Kühlschrank (oder alternativ in einem Eisbad) gekühlt. In einen 50 mL Erlenmyerkolben werden 30 mL 30% Wasserstoffperoxid gegeben und ebenfalls gekühlt.
In der Zwischenzeit wird eine Gasentwicklerapparatur wie folgt aufgebaut: In einen 500 mL Zweihalskolben werden 20g Kaliumpermanganat eingewogen und auf den mittleren Hals ein Tropftrichter, der mit 100 mL konz 31% Salzsäure gefüllt ist, aufgesetzt. Auf den Seitenhals kommt ein Übergangsstück mit Schlaucholive. Alle Schliffe werden mit Klemmen gesichert.
Eine 250 mL Gaswaschflasche wird mit einem zweiten Laborstativ gesichert, mit den gut gekühlten Lösungen beschickt und an den Gasentwickler angeschlossen (Unbedingt die korrekte Ausrichtung beachten). Das kurze Rohr der Waschflasche wird mit einem Schlauch versehen, der in den Abzugsschacht mündet, um überschüssiges Chlorgas sicher zu entfernen.
Wird der Hahn des Tropftrichters geöffnet, tropft Salzsäure auf das Kaliumpermanganat und es entsteht Chlorgas. In der Gaswaschflasche kann sofort ein rotes Aufleuchten beobachtet werden (Raum abdunkeln).
Entsorgung
Sämtliche Schliffverbindungen werden geöffnet und die Apparatur über Nacht im Abzug zum Ablüften gelassen. Die Gasentwicklerlösung kommt in den Behälter für anorganische Schwermetallabfälle, der Inhalt der Gaswaschflasche wird mit Salzsäure neutralisiert und verdünnt dem Abwasser zugeführt.
Erklärung
Chlor reagiert mit der Natronlauge unter Disproportionierung zu Hypochlorit und Chlorid. Das Hypochlorit wird dann vom Wasserstoffperoxid zum Chlorit oxidiert, welches rasch unter Entwicklung von Singulett-Sauerstoff zerfällt:
H2O2 + OCl- -> ClOO- + H2O
ClOO- -> 1O2 + Cl-
Doch was ist nun Singulett-Sauerstoff überhaupt? Dazu müssen wir uns das Molekülorbitaldiagramm von Sauerstoff ansehen. Im Grundzustand – dem Triplett-Sauerstoff – sind die Spins der Elektronen in den π* Orbitalen gemäß der Hund’schen Regel parallel ausgerichtet, beim Singulett-Sauerstoff antiparallel.
Der Singulett-Sauerstoff ist daher energiereicher und instabil. Bei der Umwandlung zum Grundzustand wird Energie in Form von rotem Licht abgegeben.
Foto
Video
Literatur
Mortimer, C. E.: Chemie – Das Basiswissen der Chemie. 13., korrigierte Auflage. Stuttgart, New York: Georg Thieme Verlag. 2019.
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
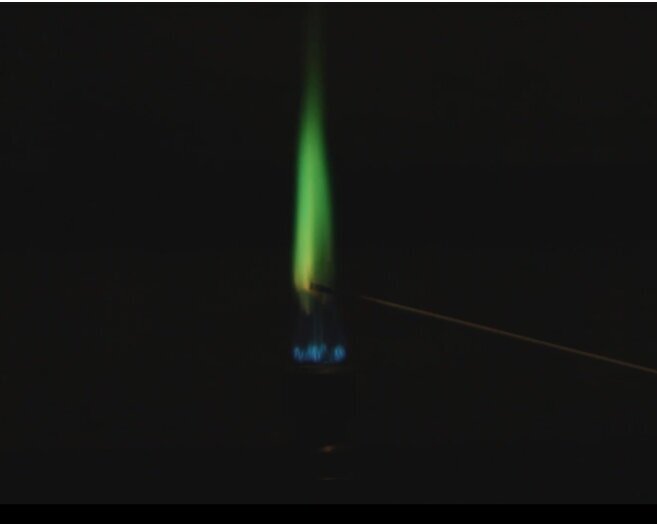
Flammenfärbung
Von Robert Wilhelm Bunsen (dem Entwickler des Bunsenbrenners) erzählt man sich folgende Geschichte:
Als er mit einem Freund in einem Restaurant essen ging, gab es Hähnchen. Sobald sie fertig waren, zückte er aus der Manteltasche ein Fläschchen und streute Lithiumchlorid über die eben abgenagten Knochen. Am nächsten Tag gingen sie wieder dorthin - es gab Hühnersuppe. Er tauchte einen Platindraht in die Suppe und hielt diesen in die Flamme eines Spiritusbrenners. Diese verfärbte sich rot, wodurch er nachgewiesen hatte, dass die abgenagten Knochen des Vortages für die Suppe verwendet wurden!
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Von Robert Wilhelm Bunsen (dem Entwickler des Bunsenbrenners) erzählt man sich folgende Geschichte:
Als er mit einem Freund in einem Restaurant essen ging, gab es Hähnchen. Sobald sie fertig waren, zückte er aus der Manteltasche ein Fläschchen und streute Lithiumchlorid über die eben abgenagten Knochen. Am nächsten Tag gingen sie wieder dorthin - es gab Hühnersuppe. Er tauchte einen Platindraht in die Suppe und hielt diesen in die Flamme eines Spiritusbrenners. Diese verfärbte sich rot, wodurch er nachgewiesen hatte, dass die abgenagten Knochen des Vortages für die Suppe verwendet wurden!
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Bunsenbrenner, Magnesiastäbchen, Feuerzeug, 2x 50 mL Becherglas, 5-6 Uhrglasschälchen, Spatel.
Chemikalien
verd. 10% Salzsäure
Natriumchlorid
Kaliumchlorid
Lithiumchlorid
Calciumchlorid
Bariumchlorid
Kupfersulfat
Durchführung
In jedes der Uhrgläser kommt ein Spatel des entsprechenden Salzes. Ein Magnesiastäbchen, welches zuvor ausgeglüht wurde, wird in dest. Wasser getaucht und damit eine kleine Menge eines beliebigen Salzes aufgenommen und in die nicht leuchtende Brennerflamme gehalten.
Danach reinigt man das Stäbchen durch Eintauchen in Wasser, dann Salzsäure, dann erneut Wasser, bevor ein anderes Salz getestet wird.
Anmerkung
Die Magnesiastäbchen sollten nur an einem Ende angefasst werden. Natriumionen durch Schweiß auf der Haut, sorgen für eine schwer zu entfernende, alles überdeckende, gelbe Flamme. Das anfängliche Ausglühen würde sich dadurch auf mehrere Minuten erstrecken.
Substituiert man giftiges Bariumchlorid mit verträglicherem Kupfersulfat, ist der Versuch als Schülerversuch durchführbar.
Entsorgung
Kupfersulfat und Bariumchlorid (sowie alle Waschlösungen bei Verwendung dieser beiden Stoffe), kommen in den Behälter für anorganische Schwermetallsalze.
Die übrigen Salze werden gut verdünnt über den Ausguss entsorgt. Nicht kontaminierte Salzsäure wird vorhergehend mit Natriumcarbonat neutralisiert (starke Gasentwicklung!).
Erklärung
Zur Erklärung kann man das Bohr'sche Atommodell heranziehen (wobei streng genommen nur das Wasserstoffspektrum damit erklärt werden kann): Demnach kreisen die Elektronen auf definierten Bahnen um den Atomkern.
Wenn wir Energie in Form von Wärme hinzufügen, gehen die Elektronen in einen angeregten Zustand über und wechseln in eine äußere Schale. Beim zurückspringen in den Grundzustand, wird diese Energie wieder in Form von Licht frei, wobei die Wellenlänge (und dadurch die Farbe) vom Energiebetrag und dadurch von der Differenz der Energien des höheren und des niedrigeren Energiezustands abhängt.
Betrachtet man dieses Licht durch ein Spektrometer, werden die einzelnen Spektrallinien sichtbar. Diese, sowie deren Verteilung, ist für jedes Element charakteristisch und dient als Nachweismethode. Die Existenz von Indium wurde erstmalig durch die indigoblaue Spektrallinie nachgewiesen (nach der das Element auch benannt wurde).
Die Spektrallienen der meisten Elemente liegen allerdings nicht im sichtbaren Bereich des Lichts: Magnesium emittiert unter anderem im UV-Bereich. Daher können wir beim dem Versuch Stäbchen aus Magnesiumoxid verwenden, ohne dass eine störende Färbung auftritt. Außerdem ist das Emittieren von UV Licht ein Grund, warum man nicht direkt in ein Magnesiumfeuer schauen soll.
Fotos
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Kaliumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Kaliumpermanganat + Glycerin = Vulkanausbruch
Mit Zischen, Rauchen und violetten Flammen eruptiert unser chemischer Vulkan wenige Sekunden nach dem Mischen. Es gibt nur wenige Experimente, die so schön demonstrieren, welch ungeheure Energie bei manchen chemischen Reaktionen freiwerden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Mit Zischen, Rauchen und violetten Flammen eruptiert unser chemischer Vulkan wenige Sekunden nach dem Mischen.
Es gibt nur wenige Experimente, die so schön demonstrieren, welch ungeheure Energie bei manchen chemischen Reaktionen freiwerden kann. Es wird gezeigt, warum Oxidationsmittel getrennt von Reduktionsmitteln gelagert werden müssen und was passieren kann, wenn man unbedacht mit starken Oxidationsmitteln experimentiert.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Feuerfeste Unterlage (z.B. Blech auf einer Waschbetonplatte), 50 mL Becherglas, Waage, 5 mL Spritze, Spatel
Chemikalien
Kaliumpermanganat
Glycerin
Hinweise
- Ausführung im Abzug!
- Nicht mehr als die angegebenen Mengen verwenden!
- Sollte die Reaktion nicht spontan starten, darf der Reaktionsansatz nicht im Müll entsorgt werden! Ein verspätetes Entzünden würde einen Brand verursachen! Vor der Entsorgung desaktivieren (siehe "Entsorgung")!
Durchführung
In einem 50 mL Becherglas werden 10 g Kaliumpermanganat eingewogen und auf die feuerfeste Unterlage im Abzug in Form eines kleinen Haufens gegeben. Mit einem Spatel wird eine kleine Mulde an der Spitze des Haufens geformt. Aus der Spritze werden vorsichtig 2 mL Glycerin hinzugefügt und der Frontschieber zügig geschlossen. Die Reaktion startet üblicherweise unter Flammenentwicklung innerhalb von 10-20 Sekunden.
Anmerkung
Es wurde sehr feinkörniges Kaliumpermanganat verwendet. Eventuell kann ein vorhergehendes Verreiben im Mörser notwendig sein.
Die Verwendung von Eisenpulver - wie an mancher Stelle angegeben - ist nach unseren Erfahrungen nicht notwendig.
Entsorgung
Den ausgekühlten Reaktionsrückstand versetzt man mit Wasser (Desaktivierung) und entsorgt das gesammelte Waschwasser im Behälter für anorganische Schwermetallabfälle. Die Spritze kann nach dem Auswachen mit dest. Wasser erneut verwendet werden oder wird im Hausmüll entsorgt (Glycerin ist kein Gefahrstoff, der eine gesonderte Entsorgung erfordert) .
Erklärung
Kaliumpermanganat reagiert exotherm (unter Hitzeentwicklung) mit dem Glycerin. Durch die Wärme wird die Reaktion beschleunigt, so dass es zu einem thermischen Durchgehen (engl. runaway) kommt und sich die Mischung entzündet.
C3H5(OH)3 + KMnO4 → CO2 + K2CO3 + H2O + K2MnO4 + MnO2 + Mn2O3
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Glycerin (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Chemische Ampel
Freie Fahrt mit Chemie! Durch die richtige Dosis Sauerstoff, lässt sich auch ein Ampelsignal steuern - zugegeben - nur nachbilden. Dieses schöne Experiment mit Indigocarmin führt in die Welt der organischen Farbstoffe und Redox-Reaktionen ein. Durch Auslotung dieses komplexen Systems, erreicht man den schönen Effekt der chemischen Ampel.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Freie Fahrt mit Chemie! Durch die richtige Dosis Sauerstoff, lässt sich auch ein Ampelsignal steuern - zugegeben - nur nachbilden. Dieses schöne Experiment mit Indigocarmin führt in die Welt der organischen Farbstoffe und Redox-Reaktionen ein. Durch Auslotung dieses komplexen Systems, erreicht man den schönen Effekt der chemischen Ampel.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
500 mL Laborgewindeflasche, 250 mL Becherglas, 500 mL Erlenmeyerkolben, Magnetrührer mit Heizplatte, Thermometer, Rührfisch, Waage, Spatel
Chemikalien
Indigocarmin
Glucose
Natriumhydroxid
Durchführung
In das 250 mL Becherglas werden 10 g Glucose eigewogen und mit 40 mL dest. Wasser verdünnt. In den Erlenmeyerkolben kommen 4,44 g Natriumhydroxid, die ihrerseits wieder mit 277,4 mL Wasser verdünnt werden. Die Natronlauge erhitzt man dann am Magnetrührer auf eine Temperatur von 40 - 50 °C.
In eine 500 mL Laborglasflasche werden dann 0,04 g Indigocarmin (eine Spatelspitze) gegeben. Es kommt die warme Natronlauge hinzu und zum Schluss die Glucose-Lösung. Die Flasche wird gut zugeschraubt und der Inhalt durch Schütteln gut vermischt.
Nach wenigen Sekunden ändert sich die Farbe von grün nach rot und geht anschließend ins Gelbe über. Durch einmal schütteln wird die Lösung wieder rot, zweimal und sie ist grün. Dies kann ein paar Mal wiederholt werden, danach verblassen die Farben.
Entsorgung
Die Lösung wird mit verdünnter Salzsäure neutralisiert und gut verdünnt dem Abwasser zugeführt.
Erklärung
Komplexe Bindungssysteme, in denen sich Elektronen freier Bewegen oder angeregt werden können (z.B. bei Doppelbindungen), sorgen für Farbe. Werden diese Bindungssysteme durch chemische Reaktionen verändert, verändert sich auch die Farbe.
Indigocarmin ist ein pH Indikator. Durch Natronlauge wird ein Teil deprotoniert - die entstehende Struktur ist gelb gefärbt. Aus der Mischung von blau und gelb entsteht grün.
Die deprotonierte Form kann dann von Glucose zum gelben Leuko-Indigo reduziert werden. Die Gleichgewichte verschieben sich so, dass keine blaue Form mehr vorhanden ist. Diese Reduktion verläuft über eine rote Zwischenstufe mit Radikal-Anion.
Die Reduktion wird durch Luftsauerstoff, der beim Schütteln in die Lösung gebracht wird, umgekehrt werden. Dabei oxidiert man das gelbe Leuko-Indigo über die rote Zwischenstufe wieder zu einer blau/gelben (für unser Auge grünen) Mischung.
Die Reaktion geht solange, bis die Glucose verbraucht ist oder der Farbstoff oxidativ zerstört wurde.
Fotos
Video
Literatur
Dr. Fritz Struber (YouTube: Helicochem)
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Indigocarmin (Kein gefährlicher Stoff nach GHS)
Glucose (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.