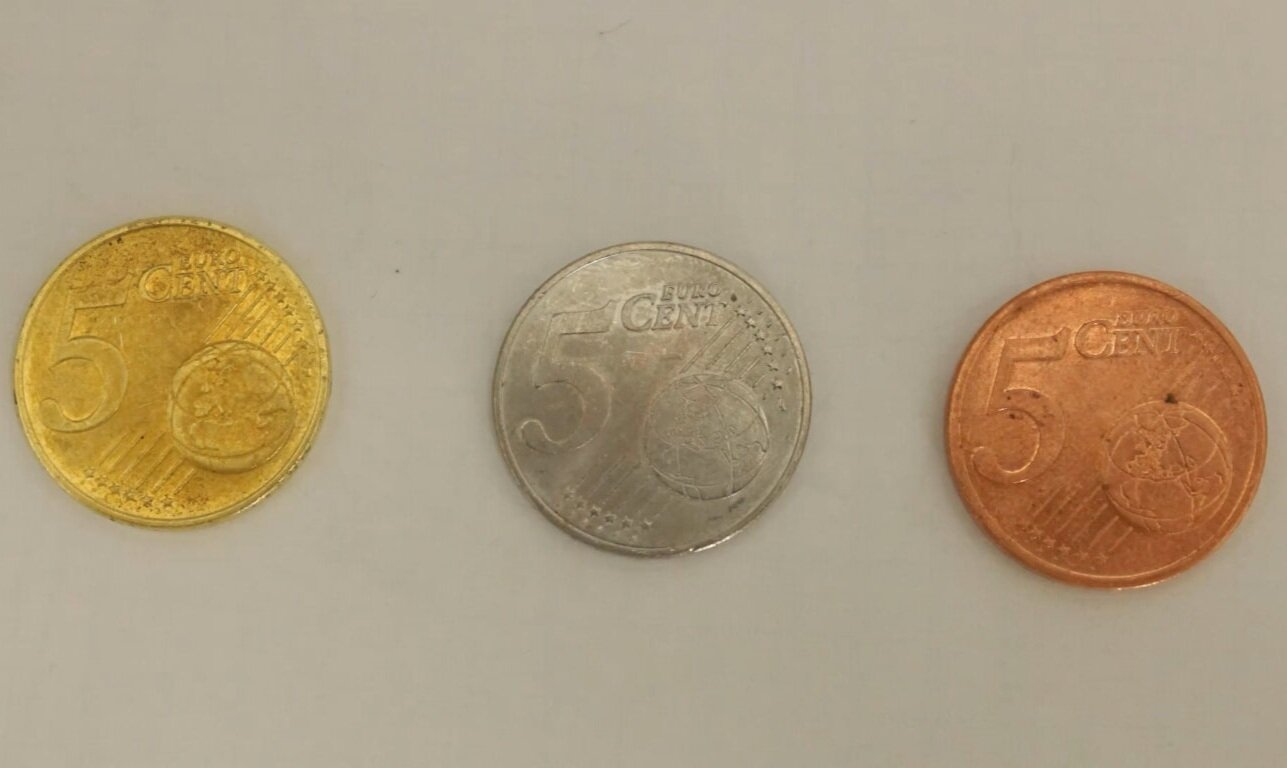Gramfärbung
Die Gram Färbung – entwickelt vom dänischen Bakteriologen Hans Christian Gram ermöglicht es, Bakterien anhand von Unterschieden im Aufbau der Zellwände zu unterscheiden. Aufgrund der Einfachheit und kurzen Zeitdauer bis zu einem Ergebnis ist die Gram Färbung auch heute noch ein wichtiges Mittel in der Diagnostik bakterieller Infektionskrankheiten.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Gramfärbung – entwickelt vom dänischen Bakteriologen Hans Christian Gram - ermöglicht es, Bakterien anhand von Unterschieden im Aufbau der Zellwände zu unterscheiden. Aufgrund der Einfachheit und kurzen Zeitdauer bis zu einem Ergebnis ist die Gramfärbung auch heute noch ein wichtiges Mittel in der Diagnostik bakterieller Infektionskrankheiten.
Schwierigkeitsgrad
Schülerexperiment - schwer
Geräte
Mikroskop, 250 ml Becherglas, 5x 50 ml Becherglas, Pasteurpipetten, Objektträger, Bunsenbrenner, Feuerzeug
Chemikalien
0,1 % ethanolische Kristallviolett Lösung
0,1 % wässrige Safranin-T Lösung
5 % Lugol’sche Lösung
Aceton
Immersionsöl
Hinweis
Kristallviolett und Safranin-T sind hervorragende Farbstoffe. Entstandene Flecken auf Kleidung oder Gegenständen lassen sich kaum mehr entfernen
Durchführung
Herstellung der benötigten Lösungen
0,1 % ethanolische Kristallviolett Lösung: 0,08 g Kristallviolett werden in 100,0 mL 96 % Ethanol gelöst.
0,1 % wässrige Safranin-T Lösung: 0,1 g Safranin T werden in 99,9 mL dest. Wasser gelöst.
5 % Lugol’sche Lösung: 5 g Iod und 10 g Kaliumiodid werden in einem 250 mL Becherglas eingewogen und mit 85 mL verdünnt.
Vorbereiten der Probe
Eine bakterienhaltige Probe (z.B. ein Tropfen Wasser aus einem Heuaufguss) wird auf einem Objektträger ausgestrichen, sodass die eingenommene Fläche ungefähr 1x1 cm entspricht und an der Luft zum Trocknen belassen. Zur Fixierung wird der Objektträger 3x durch die nicht leuchtende Brennerflamme gezogen.
Gramfärbung
Der Objektträger mit der fixierten Probe wird nun auf ein 250 mL Becherglas gelegt und die Gramfärbung entsprechend dieser Reihenfolge durchgeführt. Nach jeder Lösung ist gut mit dest. Wasser zu spülen!
0,1 % Kristallviolett Lösung (60 sek.)
5 % Lugol’sche Lösung (60 sek.).
Aceton (2 sek.)
0,1 % Safranin-T Lösung (30 sek.)
Der Objektträger wird an der Unterseite und den Rändern mit Küchenrolle abgewischt und zum endgültigen Trocknen für wenige Minuten an der Luft aufgelegt.
Interpretation
Das Präparat wird bei mind. 1000x Vergrößerung ohne Deckglas (!) unter Ölimmersion mikroskopiert. Gram-positive Bakterien erscheinen dunkelviolett, während gram-negative Arten hell bzw. zartrosa dargestellt werden.
Entsorgung
Die Färbelösungen und das Spülwasser werden im Becherglas, auf dem der Objektträger liegt, gesammelt und später als organisch-wässriger, halogenhaltiger Abfall entsorgt.
Erklärung
Gram-Positive Bakterien besitzen eine sehr dicke Zellwand die aus Peptidoglycanen (Murein) besteht. Diese Mureinhülle wird durch das Kristallviolett angefärbt und reagiert mit Lugol’scher Lösung zu einem Kompex. Aceton kann diesen Farbstoff aus der Mureinhülle nicht mehr herauswaschen.
Anders als gram-postive Bakterien, haben gram-negative nur eine sehr dünne Mureinhülle, die von einer Lipidschicht umgebeben ist. Aceton wirkt lipidlösend, wodurch das Kristallviolett ausgewaschen werden kann. Das Gegenfärben mit Safranin-T macht die ansonsten durchsichtigen Bakterien wieder sichtbar.
Das Gramverhalten ist nicht immer eindeutig. Es gibt Baktierien, die ihr Gramverhalten ändern (z.B. mit der Lebensdauer) oder auch gramunbestimmte Arten.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Carl-Roth, Merck)
wässrige 0,1 % Safranin-T Lösung (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Warmer Eiszapfen
Im Winter gehören die Eiszapfen genauso wie die Kälte einfach dazu. Doch in diesem Experiment stellen wir wortwörtlich alles auf den Kopf. Ein Eiszapfen wächst entgegen der Schwerkraft nach oben und wird auch noch sehr warm!
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im Winter gehören die Eiszapfen genauso wie die Kälte einfach dazu. Doch in diesem Experiment stellen wir wortwörtlich alles auf den Kopf. Ein Eiszapfen wächst entgegen der Schwerkraft nach oben und wird auch noch sehr warm!
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Becherglas 500 ml, Erlenmeyerkolben 500 ml, Magnetrührer und Magnetrührstäbchen, Petrischale, Trichter, Filterpapier, Uhrglasschale, Waage, (Infrarotthermometer)
Chemikalien
Natriumacetat-Trihydrat
Durchführung
Herstellung der Natriumacetatlösung:
In einem Becherglas wird 100 g Natriumacetat-Trihydrat mit einem Magnetrührstäbchen auf dem Magnetrührer erhitzt.
Das Natriumacetat-Trihydrat beginnt bei ca. 56°C sich im eigenen Kristallwasser zu lösen. Sobald die Lösung siedet, wird so lange Wasser zugetropft, bis kein fester Rückstand mehr sichtbar ist.
Um eventuelle Rückstände und Verunreinigungen zu beseitigen wird heiß filtriert. In den sauberen (!) bereit gehaltenen Erlenmeyerkolben wird bodenbedeckt Wasser vorgelegt und dieser auf den Magnetrührer gestellt. Dann wird der Trichter mit dem Filterpapier darauf platziert und sobald das Wasser im Erlenmeyerkolben siedet die Lösung vorsichtig filtriert. Der Trichter wird dabei mit einer passenden Uhrglasschale bedeckt, um Wärmeverluste durch Verdunstung zu minimieren.
Warmer Eiszapfen:
In eine Petrischale wird ein Kristallisationskeim (wenige Kristalle Natriumacetat-Trihydrat) gegeben. Dann wird vorsichtig die Natriumacetatlösung aus dem Erlenmeyerkolben auf den Kristallisationskeim gegossen.
Ist der Eiszapfen fertig aufgebaut kann mit einem Infrarotthermometer die Temperatur gemessen werden.
Anmerkung
Beim „Aufbau“ des „Eiszapfens“ muss auf einen Abstand zwischen Erlenmeyerkolben und „Eiszapfen“ geachtet werden – sonst kristallisiert die Flüssigkeit im Gefäß aus!
Entsorgung
Der Eiszapfen kann für eine erneute Verwendung wieder in den Erlenmeyerkolben gegeben und durch Erhitzen verflüssigt werden.
Ansonsten lässt sich der ausgehärtete Eiszapfen unbedenklich im Restmüll entsorgen.
Erklärung
Die Löslichkeit von Stoffen in Wasser ist temperaturabhängig. Bei höheren Temperaturen geht mehr Substanz in Lösung als bei niedrigen.
Wird nun bei einer sehr hohen Temperatur mehr Natriumacetat gelöst als bei Raumtemperatur normalerweise möglich wäre und die Flüssigkeit langsam abgekühlt, entsteht durch das Nichtvorhandensein eines Kristallisationskeimes eine übersättigte Lösung.
Sobald ein Festkörper (z.B. Natriumacetat-Kristall, großes Staubkorn) mit der Lösung in Berührung kommt, kommt es zur sofortigen Kristallisation unter Wärmeausbildung, die zuvor gespeichert wurde. Dieser Effekt wird sich beispielsweise bei Taschenwärmern zunutze gemacht.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumacetat Trihydrat (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Eisen(II)oxalat und pyrophores Eisen
Kommt massives Eisen mit Sauerstoff in Verbindung rostet es - jedoch sehr langsam. Je größer die Oberfläche ist, desto schneller passieren chemische Reaktionen. Sehr feine Eisenpartikel sind an der Luft selbstentzündlich (pyrophor). In diesem Experiment werden feine Eisenpartikel über einen chemischen Prozess erzeugt, um dann den Versuch “Pyrophores Eisen” zu demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Kommt massives Eisen mit Sauerstoff in Verbindung rostet es - jedoch sehr langsam. Je größer die Oberfläche ist, desto schneller passieren chemische Reaktionen. Sehr feine Eisenpartikel sind an der Luft selbstentzündlich (pyrophor). In diesem Experiment werden feine Eisenpartikel über einen chemischen Prozess erzeugt, um dann den Versuch “Pyrophores Eisen” zu demonstrieren.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Waage, Magnetrührer, 250 mL NS 14/23 Rundkolben, 100 mL Messzylinder, NS 14/23 Rückflusskühler, 400 mL Becherglas, Trichter, Faltenfilter, Magnetrührstäbchen, Saugflasche, Büchnertrichter mit passendem Rundfilter, Vakuumpumpe, Uhrglaschale, Reagenzglas, Stativmaterial, Brenner, Feuerzeug, feuerfeste Unterlage
Chemikalien
Eisen
konz. 32% Salzsäure
Oxalsäure-Dihydrat
Hinweis
Ausführung im Abzug!
Durchführung
Herstellung von Eisen(II)oxalat:
Ein 250 mL Rundkolben wird mit 5.5 g Eisennägel, 70 mL dest. Wasser und 30 mL Salzsäure (c = 32%) beschickt. Es wird ein Rückflusskühler aufgesetzt und die Mischung zum Sieden erhitzt, bis das gesamte Eisen aufgelöst wurde. Da Eisen magnetisch ist, muss kein Magnetrührstäbchen zum Rühren verwendet werden. In ein 400 mL Bescherglas werden 13g Oxalsäure-Dihydrat eingewogen und der erkaltete Reaktionsansatz über einen Trichter mit Faltenfilter direkt in dieses Becherglas filtriert. Unter Rühren wird die Suspension für kurze Zeit gerade bis zum Sieden erhitzt, um entstehenden Chlorwasserstoff auszutreiben und so das Gleichgewicht der Reaktion auf die Seite der Produkte zu verschieben. Das gelbe Eisen(II)oxalat wird durch Vakuumfiltration mit einem Büchnertrichter isoliert, gut mit Wasser gewaschen und auf einer Uhrglasschale vor Verwendung zwei Tage an der Luft getrocknet.
Pyrophores Eisen:
Ein großes Reagenzglas wird 1 cm hoch mit Eisen(II)oxalat befüllt und solange in der rauschenden Brennerflamme erhitzt, bis sich sämtliches Eisen(II)oxalat zu schwarzem Eisen, Eisen(II)oxid und Magnetit zersetzt hat. Das Reagenzglas wird dann aus dem Stativ ausgespannt und der Inhalt 1 m über einer feuerfesten Unterlage ausgeschüttet (Raum vorher abdunkeln!). Bei Kontakt mit Luftglühen die feinen Partikel auf.
Entsorgung
Alle Feststoffe und anfallende Lösungen kommen neutralisiert in den Behälter für anorganische Schwermetallabfälle.
Erklärung
Eisen(II)chlorid reagiert dann mit Oxalsäure zu Eisen(II)oxalat und Chlorwasserstoff. Auch unvermeidlich enthaltenes Eisen(III)chlorid reagiert zu dem entsprechenden Oxalat. Dieses ist aber in Wasser löslich und wird bei der Filtration abgetrennt.
Beim Erhitzen reagiert Eisen(II)oxalat zu Eisen(II)oxid, Kohlendioxid und Kohlenmonoxid. Ersteres disproportioniert dann zu Eisen und Magnetit:
4 FeO -> Fe + Fe3O4
Fotos
Video
Literatur
wikipedia.org
youtube.com
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Eisen (Kein Gefahrstoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
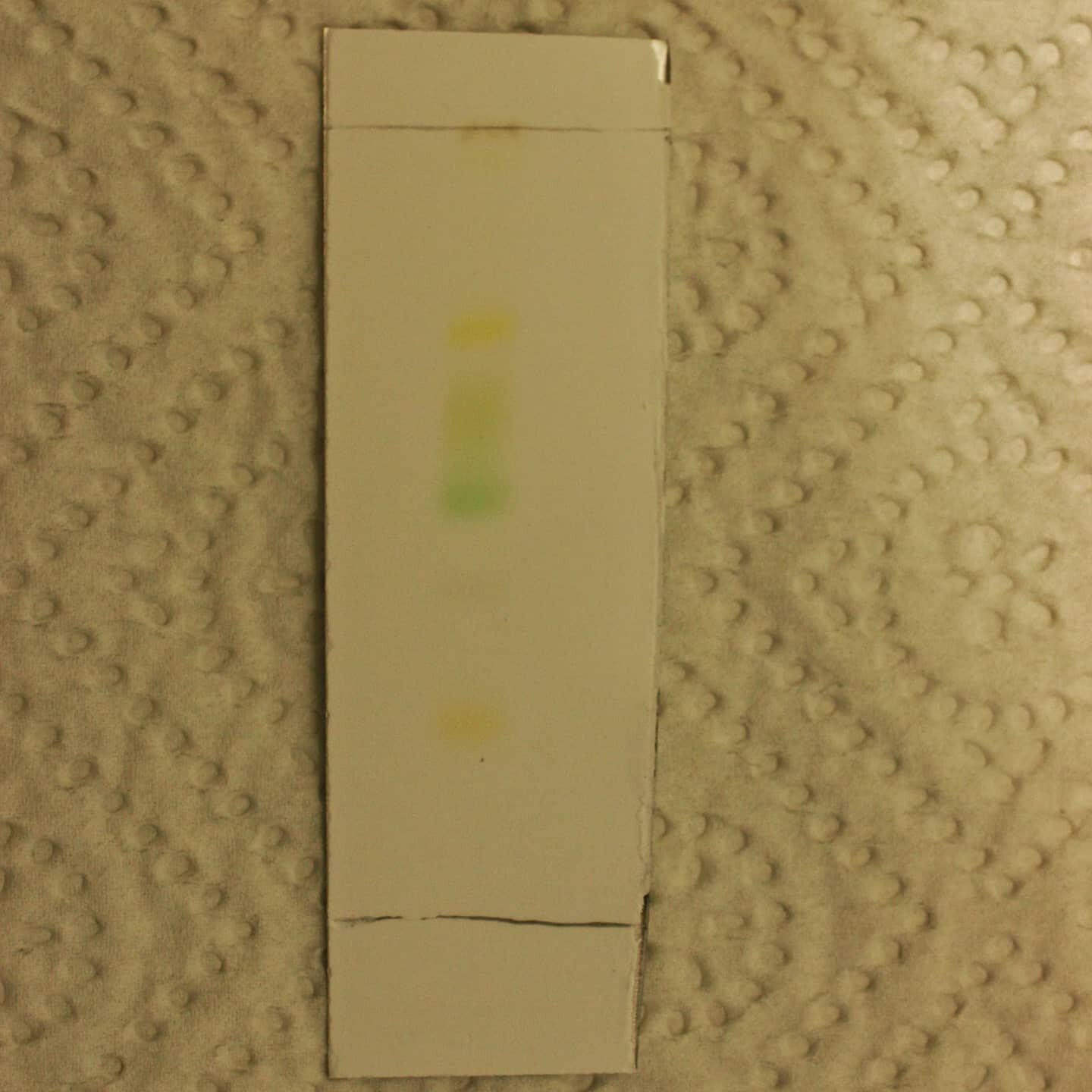
Chromatographie von Blattfarbstoffen
Im Herbst verfärben sich die Blätter sämtlicher Bäume und werden bunt. Doch wie kommt es eigentlich dazu? Um eine Erklärung zu finden, müssen die Blätter zuerst mit einem geeigneten Verfahren untersucht werden. Hierbei ist die Auftrennung und Analyse über eine Dünnschichtchromatographie am zweckmäßigsten, welche von Schülern problemlos selbst durchgeführt werden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Im Herbst verfärben sich die Blätter sämtlicher Bäume und werden bunt. Doch wie kommt es eigentlich dazu? Um eine Erklärung zu finden, müssen die Blätter zuerst mit geeigneten Verfahren untersucht werden. Hierbei ist die Auftrennung via Dünnschichtchromatographie und UV/VIS-Spektroskopie am zweckmäßigsten.
Schwierigkeitsgrad
Schülerexperiment, mittel
Geräte
Macherey-Nagel DC Platten ALUGRAM Sil G/UV254 5x7,5 cm, Mikroliterpipette 1-5 µl mit passenden Spitzen, Schraubdeckelglas, Reibschale mit Pistill, Quarzsand, Faltenfilter, Pasteurpipette, Reagenzglas und Reagenzglasständer, Messpipetten, Bleistift und Geodreieck, Pinzette, UV/VIS-Spektrometer, PS Küvetten
Chemikalien
Ethanol
Ethylacetat
Cyclohexan
Hinweis
DC Platten niemals ohne Handschuhe angreifen, da Feuchtigkeit die Trennleistung mindert. Kurzwelliges UV-Licht ist für die Augen sehr schädlich!
Durchführung
Vorbereitung:
Zuerst wird das Probenmaterial besorgt: Das können z.B. Blätter von Bäumen sein. Stehen diese nicht zur Verfügung, eignet sich auch eingefrorener Spinat hervorragend für dieses Experiment.
Das pflanzliche Material wird dann im Mörser mit etwas Sand versehen und vollständig mit Ethanol bedeckt. Durch Zerreiben werden die Pflanzenfarbstoffe rasch extrahiert und der Ethanol nimmt eine intensiv-grüne Farbe an. Durch Filtration über einen Faltenfilter werden alle störenden Schwebstoffe entfernt. Insbesondere für die UV/VIS-Spektroskopie muss die Probenlösung klar sein.
Dünnschichtchromatographie:
Für die Dünnschichtchromatographie muss zuerst das Laufmittel hergestellt werden: Dazu wird Cyclohexan und Ethylacetat im Verhältnis 3:1 gemischt. Für ein handelsübliches 450 g Marmeladenglas – das als Entwicklungskammer zweckentfremdet wird - sind ca. 10-15 mL Laufmittel notwendig. Es werden also zuerst 9 mL Cyclohexan gefolgt von 3 mL Ethylacetat in das Glas pipettiert und durch Schwenken vermischt. Um die Kammer mit Dampf zu sättigen, werden die Wände mit Küchenpapier ausgekleidet. Durch den Kontakt mit dem Laufmittel haften diese von selbst am Glas.
Während sich die Kammer äquilibriert, wird die DC Platte vorbereitet. Dazu wird 1 cm über dem unteren Rand der DC Platte unter Zuhilfenahme eines Geodreiecks ein gerader Strich mit einem weichen Bleistift gezeichnet. Auf dieser Hilfslinie werden dann mittels Mikroliterpipette 3x 5 µl Blattextrakt aufgetragen. Zwischen den Intervallen muss die Platte kurz trocknen, ansonsten breiten sich die Substanzflecken zu weit aus. Das Ziel ist, Substanzflecken in der Größe von 2-3 mm zu haben, um eine optimale Trennung zu gewährleisten. Es funktioniert sehr gut, mehrere Substanzflecken aneinander zu setzen, so dass die Auftragungszone entlang der Hilfslinie größer wird. Die Kieselgel-Schicht darf während des Auftragens nicht beschädigt werden.
Die betüpfelte DC Platte wird aufrecht in die Entwicklungskammer gestellt. Durch Kapillarkräfte steigt das Laufmittel entlang der Platte nach oben. Ist die Laufmittelfront nach 5-10 min ca. 1 cm vom oberen Rand entfernt, wird die DC-Platte mit einer Pinzette aus der Kammer genommen und die Laufmittelfront eingezeichnet, um später den Rf-Wert zu berechnen.
Die luftgetrocknete DC-Platte kann nun unter kurzwelligem (254 nm) und langwelligem (366 nm) UV-Licht betrachtet werden. Auf der DC-Platte befindet sich ein Fluoreszenzindikator, der unter kurzwelligem UV-Licht grün fluoresziert. Durch Fluoreszenzlöschung erscheinen Substanzflecken dunkel. Unter langwelligem UV-Licht besitzen manche Farbstoffe selbst eine Fluoreszenz. Auch die Betrachtung unter sichtbarem Licht eignet sich bei farbigen Substanzen.
Der Rf-Wert wird nach folgender Formel berechnet:
Rf = Laufstrecke Substanz / Abstand Auftragunglinie zur Laufmittelfront
UV/VIS-Spektroskopie:
Die Probenlösung wird mit einer Pasteurpipette in eine Küvette aus Polystyrol überführt und im UV/VIS-Spektrometer gemessen.
Entsorgung
Alle Lösungsmittel kommen in den Behälter für organische, halogenfreie Abfälle.
Erklärung
Dünnschichtchromatographie:
Die mobile Phase – das Laufmittel - schleppt alle Farbstoffe mit. Diese haben aber aufgrund ihres unterschiedlichen Aufbaus unterschiedlich starke Wechselwirkungen mit der stationären Phase – dem Kieselgel. Manche Farbstoffe werden vom Kieselgel stärker zurückgehalten, andere schwächer. Das führt zu einem Trenneffekt und das zuvor homogene Gemisch kann in seien Bestandteile zerlegt und analysiert werden.
UV/VIS-Spektroskopie:
Im UV/VIS-Spektrometer wird Licht mit definierter Wellenlänge auf die Probe gestrahlt und mit einem Detektor gemessen, wie viel davon absorbiert wird. So absorbieren Chlorophyll A und B blaues und rotes Licht, reflektieren aber grünes Licht (weshalb wir Pflanzen als „grün“ wahrnehmen). Aber wie die Dünnschichtchromatographie gezeigt hat, besteht der Blattextrakt nicht nur aus grünem Chlorophyll – auch im UV/VIS-Spektrum kann das Absorbtionsmaximum von beta-Carotin bei 475 nm identifiziert werden.
Antwort auf die Eingangsfrage: Warum verfärben sich die Blätter im Herbst ?
Würde man ein Blatt aus dem Sommer und eines aus dem Herbst vergleichen, würde man sehen, dass die Rf-Werte gleichbleiben – also dieselben Substanzen im Blatt vorkommen. Was sich ändert, ist die Zusammensetzung. Grünes Chlorophyll wird im Herbst tiefer im Stamm eingelagert, orange und rote Carotinoide bzw. Xantophylle kommen dann zum Vorschein.
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Sichtbarmachung von Teilchen mittels Diffusions-Nebelkammer
Eine Nebelkammer ist ein einfacher Detektor, mit dem sich Spuren von hindurchfliegenden Teilchen sichtbar machen lassen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Eine Nebelkammer ist ein einfacher Detektor, mit dem sich Spuren von hindurchfliegenden Teilchen sichtbar machen lassen. In unserem Shop bieten wir Ihnen an eine Nebelkammer zu erwerben, damit Sie auch selbst kosmische und radioaktive Teilchen sichtbar machen können.
Schwierigkeitsgrad
Demonstrationsexperiment - leicht
Chemikalien
Trockeneis-Platte
Isopropanol (80%)
Materialien
Hinweis
Nebelkammern können rein mit natürlich vorkommender Hintergrundstrahlung betrieben werden. Der Einsatz radioaktiver Präparate wird nicht empfohlen.
Durchführung
Trockeneis vorbereiten: In die Styroporbox kommt eine Trockeneis-Platte - die Aluplatte wird auf das Trockeneis gelegt. Wichtig ist, dass sie überall damit in Kontakt kommt, um gleichmäßig abkühlen zu können.
Alkohol einfüllen: Anschließend wird der Filz mit Isopropanol getränkt, bis er vollgesogen ist. Überschüssigen Alkohol lässt man abtropfen. Die Box wird mit der Öffnung nach unten auf die Aluplatte gestellt.
Äquilibrierung der Nebelkammer: in den nächsten 5-10 min sollte der Versuchsaufbau nicht bewegt oder geöffnet werden. So wird verhindert, dass Luft hineingelangt.
Spuren beobachten: Im abgedunkelten Raum wird die Nebelkammer von der Seite mit einerTaschenlampe beleuchtet. Wenn Tröpfchen, die in Richtung Boden fallen, erkennbar sind, ist die Nebelkammer bereit. Nun sollten mehrmals pro Minute feine weiße Spuren im Nebel zu erkennen sein.
Entsorgung
Isopropanol lässt man im Abzug verdunsten. Mit überschüssigem Trockeneis können andere Experimente durchgeführt werden, ansonsten lässt man es an einem gut belüfteten Ort sublimieren.
Erklärung
Der Alkohol verdunstet, bis die Luft im Inneren der Kammer mit Alkoholdampf gesättigt ist. Ein Gasvolumen kann bei einer bestimmten Temperatur nur eine begrenzte Menge Flüssigkeit aufnehmen; je höher die Temperatur ist, desto mehr Flüssigkeit kann vom Gas gehalten werden. Das Trockeneis kühlt den unteren Teil der Kammer stark ab, sodass der Alkoholdampf in diesem Bereich wieder kondensieren müsste. Da jedoch keine Kondensationskeime vorhanden sind, geht der Alkoholdampf in einen übersättigten Zustand über; das heißt, die Luft enthält mehr Alkoholdampf, als für diese Temperatur normal ist. Fliegt nun ein elektrisch geladenes Teilchen durch die übersättigte Schicht, erzeugt es zahlreiche Ionen entlang der Flugbahn. An diesen Ionen kann der Alkoholdampf kondensieren, sodass sichtbare Spuren aus Alkoholtröpfchen entstehen.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Trockeneis (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
"Versilbern/-golden" einer Kupfermünze
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Bis ins 18. Jahrhundert versuchten Alchemisten Gold künstlich herzustellen (synthetisieren). Viele Elemententdeckungen, weite Teile der chemischen Experimentierkunst und viele Glasgeräte gehen auf diese Zeit zurück - doch leider blieb die Entdeckung des Steins der Weisen aus. In diesem Experiment wird eine Kupfermünze zuerst mit Zink überzogen ("versilbert") und anschließend „vergoldet“.
Schwierigkeitsgrad
Schülerversuch - mittel
Geräte
Becherglas, Tiegelzange, Magnetrührer, Magnetrührstäbchen, Kupfermünzen, Bunsenbrenner, Thermometer
Chemikalien
Kaliumhydroxid
Zinkpulver
Ethanol
Durchführung
Eine Kupfermünze wird in ein kleines Becherglas mit 100 mL 10 %iger Kalillauge (hergestellt aus 10 g Kaliumhydroxid und 90 mL Wasser) und 6 g Zinkpulver gegeben. Die Kalilauge sollte dabei eine Temperatur von 80 °C aufweisen. Nach 2-3 Minuten (wobei längere Einwirkzeiten das Ergebnis verbessern) hat eine Zinkschicht die gesamte Kupfermünze bedeckt. Diese wird mit einer Tiegelzange herausgenommen und durch Putzen mit Küchenrolle von überschüssigem Zink und Wasser befreit. Anschließend wird die Münze so lange in der Brennerflamme erwärmt, bis sie vollständig „vergoldet“ erscheint.
Entsorgung
Die überschüssige Lösung im Sammelbehälter für giftige anorganische Rückstände sowie Schwermetall-Salze und ihre Lösungen entsorgen.
Hinweis
Vor dem Versuch unbedingt die Kupfermünzen gut mit Spülmittel oder Ethanol reinigen und nur mit Handschuhen berühren!
Erklärung
Das Zinkpulver ist an der Oberfläche mit einer festen Zinkoxid- (ZnO) Schicht überzogen und somit passiviert. Dieses ZnO geht im basischen Milieu als Tetrahydroxozinkat in Lösung und scheidet sich an der Kupfermünze ab. Das steht im Widerspruch mit den Standardpotentialen, weil sich ein unedleres Metall (Zink) am edleren Metall (Kupfer) abscheidet. Tetrahydroxozinkat als Komplex hat aber ein anderes Standardpotential als Zink, weshalb Kupfer „unedler“ als der Komplex ist und die Reaktion abläuft.
Durch das Erhitzen der Münzen im Bunsenbrenner wird die Bildung einer Legierung zwischen den zwei Metallen – Messing - beschleunigt. Es kommt zu einem typischen Metallgitter aus verschiedenen Metallionen (Zn und Cu) und freibeweglichen Elektronen.
Foto
Video
Quelle
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Brennender Geldschein
Dieses eindrucksvolle Show-Experiment bleibt sicher jedem Publikum für einige Zeit in Erinnerung. Ein (echter!) Geldschein wird vor ihren Augen angezündet - verbrennt jedoch nicht.
Das Experiment kann hervorragend dafür verwendet werden um eine - verhältnismäßig - “kalte” Verbrennung zu demonstrieren. Zudem vermittelt das Entzünden eines wertvollen Scheins die 100%ige Sicherheit des Vorführenden, mit der die Experimente idealerweise vorbereitet vorgeführt werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Dieses eindrucksvolle Show-Experiment bleibt sicher jedem Publikum für einige Zeit in Erinnerung. Ein (echter!) Geldschein wird vor ihren Augen angezündet - verbrennt jedoch nicht.
Das Experiment kann hervorragend dafür verwendet werden um eine - verhältnismäßig - “kalte” Verbrennung zu demonstrieren. Zudem vermittelt das Entzünden eines wertvollen Scheins die 100%ige Sicherheit des Vorführenden, mit der die Experimente idealerweise vorbereitet vorgeführt werden.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
250 ml Becherglas, feuerfeste Zange oder Pinzette, Geldschein (beliebiger Wert), Kristallisierschale, Bunsenbrenner
Chemikalien
96% Ethanol (Brennspiritus)
Natriumchlorid (Kochsalz)
Durchführung
In dem Becherglas wird Ethanol im Verhältnis 1:1 mit dest. Wasser gemischt. Dazu kommt ein Löffel Natriumchlorid, wobei die Flüssigkeit in eine Kristallisierschale vom unlöslichen Rückstand dekantiert wird.
Mithilfe der Pinzette wird der Geldschein mit der Ethanol-Wasser-Mischung getränkt und dann am unteren Ende (z.B. mit einem Bunsenbrenner) angezündet.
Im (abgedunkelten!) Raum ist, sobald der Schein entzündet wird, eine gelb-orange Flamme zu erkennen, die sich bis zum oberen Ende des Geldscheins bewegt und kurz darauf erlischt.
Anmerkung
Entsorgung
Ethanol-Wasser-Mischung sowie reines Kochsalz kann im Ausguss entsorgt werden.
Erklärung
Flammen bestehen aus brennenden Gasen. Beim hier verwendeten Ethanol-Wasser-Gemisch verdampft der Ethanol und entzündet sich.
Die bei der Verbrennung entstehende Wärme verdampft weiteren Ethanol und erhält somit die Verbrennung. Gleichzeitig entsteht aber auch Wasser, welches auf Grund seiner hohen Wärmekapazität und Verdampfungsenthalpie jedoch kaum verdampft und dafür sorgt, dass die Temperatur nicht die für die Entzündung von Cellulose nötigen 170°C erreicht.
Das Gemisch verarmt mit der Zeit immer mehr an Ethanol, bis die Konzentration von Ethanol in der Gasphase unter 3,5% sinkt. Die ist die untere Grenze für die Entzündbarkeit von Ethanol, wodurch die Flamme ausgeht.
Das im Natriumchlorid enthaltene Natrium sorgt für die gelb-orange Färbung, da Ethanol normalerweise mit einer nur schwer sichtbaren bläulichen Flamme verbrennt.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumchlorid (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Wasser auf Schwefelsäure
Den Leitsatz »Erst das Wasser, dann die Säure, sonst geschieht das Ungeheure!« bekommt beinahe jeder Schüler im Chemieunterricht zu Ohren. In diesem Experiment missachten wir - unter Einhaltung der nötigen Sicherheitsvorkehrungen - bewusst dieses Grundprinzip und sehen was passiert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Den Leitsatz »Erst das Wasser, dann die Säure, sonst geschieht das Ungeheure!« bekommt beinahe jeder Schüler im Chemieunterricht zu Ohren. In diesem Experiment missachten wir - unter Einhaltung der nötigen Sicherheitsvorkehrungen - bewusst dieses Grundprinzip und sehen was passiert.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Messzylinder 1000mL, säurefeste Handschuhe, Schutzbrille, Tropfpipette, Uhrglasschale
Chemikalien
konz. 96% Schwefelsäure
Natriumcarbonat
Durchführung
In einen sehr hohen Messzylinder wird bodenbedeckt (20 mL) konz. Schwefelsäure vorgelegt. Der Messzylinder wird mit einer Uhrglasschale bedeckt, um mögliche Säurespritzer abzufangen. Über den kleinen Spalt, zwischen Schnabel des Zylinders und Uhrglasschale, wird mit der Tropfpipette vorsichtig Wasser auf die Schwefelsäure getropft.
Entsorgung
Lösung großzügig mit Wasser verdünnen, mit Natriumcarbonat neutralisieren (Gasentwicklung!) und dem Abwasser zuführen.
Erklärung
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Kristallwasser in Kupfersulfat
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Reagenzglas, Stativ + Klemme, Bunsenbrenner, Feuerzeug
Chemikalien
Kupfersulfat
Durchführung
Das Reagenzglas wird mit einer kleinen Menge Kupfersulfat befüllt und am Stativ in der Brennerflamme vorsichtig erhitzt. Es bilden sich Kondensat-Tropfen die nach der Zeit vollständig verdampfen, während das Kupfersulfat seine blaue Farbe verliert. Gibt man nun wieder Wasser hinzu verfärbt sich das Kupfersulfat wieder nach blau.
Entsorgung
Kupfersulfat wird im Behälter für anorganische Schwermetallabfälle gesammelt.
Erklärung
Die fünf Wassermoleküle sind im Kupfersulfat-Gitter unterschiedlich gebunden. Vier davon sind quadratisch-planar an Cu 2+ koordiniert und lassen sich bis 100°C abspalten. Das fünfte Wassermolekül sitzt über H-Brücken am Sulfat-Anion und lässt sich erst oberhalb von 200°C entfernen.
Die eigentliche Formel von wasserhaltigem Kupfersulfat wäre also [Cu(H 2 O) 4 ]SO 4 ·H 2 O.
Die Farbigkeit von Übergangsmetallkomplexen kommt durch die Beeinflussung der Elektronen des Zentralatoms durch das elektrische Feld von an das Zentralatom koordinierten Liganden zustande. Gehen diese Liganden "verloren" (wie im Beispiel von Kupfersulfat das Wasser), besteht kein elektrisches Ligandenfeld mehr und die Verbindung wird farblos.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, 2020)
werbung
Verbrennung von Borsäuretrimethylester
Kupfersulfat-Pentahydrat ist in der Regel ein blaues kristallines Pulver. Wird es jedoch erhitzt ändert sich seine Farbe zu weiß/grau. Der Grund dafür ist das Kristallwasser, das zuvor noch im Kristallgitter eingeschlossen ist und beim Erhitzen abgegeben wird. Fügt man nach dem Erkalten Wasser hinzu, wird das Salz wieder blau.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die grüne Flammenfärbung des Esters kann analytisch als Indiz für die Anwesenheit von Borsäure bzw. Boraten dienen. Dieser Nachweis ist sogar so empfindlich, dass er durch Spuren von Borsäure (z.B. aus den in Laboren verwendeten Borosilikatgläsern) ausschlägt. Wir zeigen den Versuch gerne als Demonstrationsexperiment einer grünen Flammenfarbe.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Feuerfeste Unterlage, Metallschale, 800 mL Becherglas, Spatel, Feuerzeug
Chemikalien
konz. 96% Schwefelsäure
Methanol
Borsäure
Hinweise
Ausführung im Abzug! Borsäure und entstehendes Bortrioxid sind reproduktionstoxisch!
Durchführung
In die Metallschale wird ein Spatel Borsäure gegeben und mit 15 mL Methanol aufgefüllt. Nun werden noch ca. 10 Tropfen konz. Schwefelsäure hinzugegeben und mit einem Spatel umgerührt.
Die Lösung wird mit dem Feuerzeug entzündet – es kommt zu einer grünen Flammenfarbe. Um die Reaktion zu beenden wird die Schale mit dem Becherglas abgedeckt und die Flamme dadurch erstickt.
Entsorgung
Die Lösung wird in den Sammelbehälter für halogenfreie organische Lösemittel gegeben.
Erklärung
Borsäure reagiert in Gegenwart von konzentrierter Schwefelsäure mit Methanol zum Borsäuretrimethylester. Die Reaktion (Veresterung) wird durch die wasserentziehende und katalytische Wirkung der konz. Schwefelsäure begünstigt.
Borsäuretrimethylester ist leicht flüchtig und lässt sich beim Entzünden des überschüssigen Methanols über die grüne Flamme identifizieren.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Tollens-Test - Silberspiegel
Der Tollens-Test ist – wie die Fehling-Probe – eine sehr empfindliche Nachweismethode für Aldehyde oder andere reduzierend wirkende Verbindungen.
Aber es gibt auch eine andere Anwendung: Bevor man technisch in der Lage war, Oberflächen mit Metallen zu bedampfen, um Spiegel zu erzeugen, wurden diese mit Tollens-Reagenz verspiegelt. Christbaumkugeln werden auch heute noch so hergestellt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Der Tollens-Test ist – wie die Fehling-Probe – eine sehr empfindliche Nachweismethode für Aldehyde oder andere reduzierend wirkende Verbindungen.
Aber es gibt auch eine andere Anwendung: Bevor man technisch in der Lage war, Oberflächen mit Metallen zu bedampfen, um Spiegel zu erzeugen, wurden diese mit Tollens-Reagenz verspiegelt. Christbaumkugeln werden zum Teil auch heute noch so hergestellt.
Schwierigkeitsgrad
Schülerversuch - schwer
Geräte
sauberes (!) Reagenzglas, Reagenzglasständer, 100 mL Erlenmeyerkolben, Pasteurpipetten
Chemikalien
Silbernitratlösung 0,1 mol/L
konz. Salmiakgeist (25-30 %)
Natriumhydroxid
Glucose
Hinweis
Durchführung
In ein kleines Reagenzglas werden 2,5 mL 0,1 molare Silbernitratlösung gegeben. Hinzu kommen einige wenige Körnchen Natriumhydroxid. Die Lösung wird dann mit so viel konz. Salmiakgeist versetzt, bis sich der entstehende Niederschlag wieder auflöst (genau arbeiten, nicht zu viel hinzugeben). Dann werden 1,5 mL gesättigte Glucoselösung hinzugegeben und das Reagenzglas im Wasserbad bei 60-70 °C erwärmt. Es scheidet sich innerhalb von einer Minute elementares Silber an der Gefäßwand ab – es entsteht ein Silberspiegel. Das Reagenzglas wird zum Schluss dreimal mit dest. Wasser ausgewaschen – der Spiegel bleibt so über längere Zeit stabil.
Entsorgung
Das Waschwasser sowie die gebrauchte Verspiegelungslösung werden mit überschüssiger Glukose versetzt und so das gesamte Silber reduziert. Nach einem Tag filtriert man: Das Filtrat kommt gut verdünnt in den Abfluss, der Niederschlag in den Behälter für anorganische Schwermetallabfälle.
Erklärung
Da Salmiakgeist alkalisch ist, bildet sich Silber(I)oxid als Niederschlag.
Mit weiterem Salmiakgeist geht Silber(I)oxid in den löslichen Diamminsilber(I)-komplex über.
Bei Zugabe von Glucose (einer Aldose), wird die Aldehydgruppe zur Carbonsäure oxidiert, während der Silberkomplex zu elementarem Silber reduziert wird.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank, Carl Roth)
Glucose (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Entfärben von Cola
Aktivkohle verwendet man im Labor bzw. in der organischen Synthesechemie, um Verfärbungen - beispielsweise beim Umkristallisieren - zu entfernen. Das zugrunde liegende Trennverfahren – die Adsorbtion – ist technisch höchst relevant und soll hier demonstriert werden.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Aktivkohle verwendet man im Labor bzw. in der organischen Synthesechemie, um Verfärbungen - beispielsweise beim Umkristallisieren - zu entfernen. Das zugrunde liegende Trennverfahren – die Adsorption – ist technisch höchst relevant und soll hier demonstriert werden.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
2x 50 mL Erlenmeyerkolben, 2x Trichter, Filterpapier, Spatel
Chemikalien
Aktivkohle (pulv.)
Durchführung
Ungefähr 30 mL Cola werden in einen Erlenmeyerkolben gegeben und darin 2-3 Spatel Aktivkohle suspendiert. Wird die Aktivkohle dann durch Filtration entfernt, ist das anfänglich schwarze Cola farblos.
Anmerkung
Die Filtration gelingt am besten, wenn drei Filter ineinander gestapelt und vor der Filtration mit dest. Wasser angefeuchtet werden.
Entsorgung
Alle Rückstände werden entweder im Ausguss oder Hausmüll entsorgt.
Erklärung
Aktivkohle ist sehr poröser Kohlenstoff, mit einer Oberfläche von 300-2000 m2/g. Viele Stoffe (wie z.B. der Farbstoff der Cola) lagern sich durch Adhäsion an dieser Oberfläche an und werden „aus dem Verkehr gezogen“. Die Einsatzgebiete von Aktivkohle sind sehr weitläufig, exemplarisch sind die folgenden erwähnenswert:
Medizin: Bindung von oral aufgenommenen Giftstoffen
Technik: Reinigung von Flüssigkeiten und Gasen (z.B. Giftstoffe aus der Luft in
Gasmaskenfilter)Katalyse: Trägermaterial für Edelmetallkatalysatoren (beispielsweise Pd/C für Hydrierungen)
Foto
Video
Gefährdungsbeurteilung
Aktivkohle (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Rauchende Socken
Dass es im Labor schnell mal unter dem Abzug raucht ist fast normal - und dass einem in der Chemie der Kopf raucht, kommt auch öfters vor. Aber rauchende Socken, die gibt es doch eigentlich nur nach einer Wanderung? Wir lassen das folgende Experiment für sich sprechen:
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Dass es im Labor schnell mal unter dem Abzug raucht ist fast normal - und dass einem in der Chemie der Kopf raucht, kommt auch öfters vor. Aber rauchende Socken, die gibt es doch eigentlich nur nach einer Wanderung? Wir lassen das folgende Experiment für sich sprechen:
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
2x 250 mL Bechergläser, säurefeste Handschuhe, Socken
Chemikalien
konz. Salzsäure
konz. Salmiakgeist
Hinweis
Durchführung
Ein Becherglas wird bodenbedeckt mit Salzsäure befüllt, das andere mit Salmiakgeist. Unter Verwendung von Handschuhen werden die beiden Socken in die Lösungen getaucht und dann nahe zusammengehalten. Es entsteht ein weißer Rauch.
Entsorgung
Nach dem Neutralisieren gut verdünnt über den Ausguss.
Erklärung
Salzsäure ist die wässrige Lösung eines Gases, nämlich Chlorwasserstoff. Auch Salmiakgeist ist in Wasser gelöstes - gasförmiges - Ammoniak. Beide Lösungen geben bei hoher Konzentration eine nicht unerhebliche Menge dieser Gase an die Luft ab.
Treffen diese aufeinander, reagieren sie und bilden ein Salz: Ammoniumchlorid.
So kann man das bei Neutralisationsreaktionen entstehende Salz beobachten, ohne zuvor – bei der Durchführung in wässriger Lösung – das Wasser verdampfen zu müssen.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Kalium in Wasser
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Kalium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar beim Kontakt mit Wasser. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Kalium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren. In diesem Experiment unserer Reihe Alkalimetalle in Wasser wird das Verhalten von Kalium im Wasser veranschaulicht.
Schwierigkeitsgrad
Demonstrationsexperiment - schwer
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer
Chemikalien
Kalium
0,1% Phenolphthalein-Lsg. (ethanolisch)
Hinweis
Durchführung
Die Wanne wird zu dreiviertel mit Wasser gefüllt und ein Filterpapier in die Mitte der Wanne auf die Wasseroberfläche gelegt. Nun wird ein ca. stecknadelkopfgroßes Stück Kalium – welches vorher mit dem Messer entkrustet und mit Küchenrolle von der Schutzflüssigkeit befreit wurde - vorsichtig auf das Filterpapier gelegt. Das Kalium entzündet sich sofort bei Kontakt mit Wasser und verbrennt mit einer lila Flamme. Das Wasser wird nach der Reaktion mit ein paar Tropfen Phenolphthalein-Lösung versetzt – ein Farbumschlag ist zu beobachten.
Anmerkung
Der Versuch muss unbedingt abseits von brennbaren Gegenständen durchgeführt werden!
Entsorgung
Die entstandene Kalilauge wird neutralisiert und kann im Abguss entsorgt werden. Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Kaliumstückchen zu entfernen.
Erklärung
Wenn Alkalimetalle wie Kalium mit Wasser in Kontakt kommen, läuft eine heftige exotherme Reaktion unter Wasserstofffreisetzung ab.
Das entstandene Kaliumhydroxid löst sich im Wasser und bildet so eine schwache Kalilauge, darum färbt sich Phenolphthalein violett.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank + Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Flüssig-Flüssig-Extraktion
Die Flüssig-Flüssig-Extraktion ist eine klassische Trennmethode in der organischen Synthesechemie mit der häufig Reaktionsgemische aufgearbeitet werden. Dabei wird die unterschiedliche Löslichkeit von Stoffen in zwei nicht miteinander mischbaren Lösungsmitteln (z.B. Wasser/Cyclohexan) genutzt.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Flüssig-Flüssig-Extraktion ist eine klassische Trennmethode in der organischen Synthesechemie mit der häufig Reaktionsgemische aufgearbeitet werden. Dabei wird die unterschiedliche Löslichkeit von Stoffen in zwei nicht miteinander mischbaren Lösungsmitteln (z.B. Wasser/Cyclohexan) genutzt.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
2x 25 mL Erlenmeyerkolben, 100 mL Scheidetrichter mit Stopfen, Stativmaterial
Chemikalien
Iod
Kaliumiodid
Cyclohexan
Natriumthiosulfat
Durchführung
In einem 25 mL Erlenmeyerkolben werden in 10 mL dest. Wasser nacheinander ein Spatel Kaliumiodid und eine Spatelspitze Iod gelöst. Im anderen Erlenmeyerkolben werden 10 mL Cyclohexan vorbereitet.
In den Scheidetrichter wird zuerst die Iod-Lösung und dann das farblose Cyclohexan hinzugegeben. Nach kräftigem Ausschütteln ist geht das Iod in die organische Phase über – diese färbt sich intensiv violett – und die wässrige Phase ist weniger intensiv braun gefärbt.
Entsorgung
In den Scheidetrichter wird etwas verdünnte Natriumthiosulfat-Lösung gegeben, wodurch sich nach dem Schütteln beide Phasen entfärben. Diese beiden Phasen werden getrennt: Das Cyclohexan lässt man im Abzug verdunsten und die wässrige Phase kann am nächsten Tag (nachdem sich eventuell gelöstes Cyclohexan verflüchtigt hat) gut verdünnt im Ausguss entsorgt werden.
Erklärung
Iod ist in Wasser nahezu unlöslich, jedoch in organischen Lösungsmitteln gut löslich. Das hinzugegebene Kaliumiodid bildet gemeinsam mit dem Iod in einer Gleichgewichtsreaktion wasserlösliche Polyiodidionen:
Da es sich um eine Gleichgewichtsreaktion handelt, ist elementares Iod verfügbar und durch die bessere Löslichkeit in organischen Lösungsmitteln extrahierbar. Dies lässt sich an der violetten Färbung des Cyclohexans erkennen.
Foto
Video
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Natriumthiosulfat (Kein gefährlicher Stoff nach GHS)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
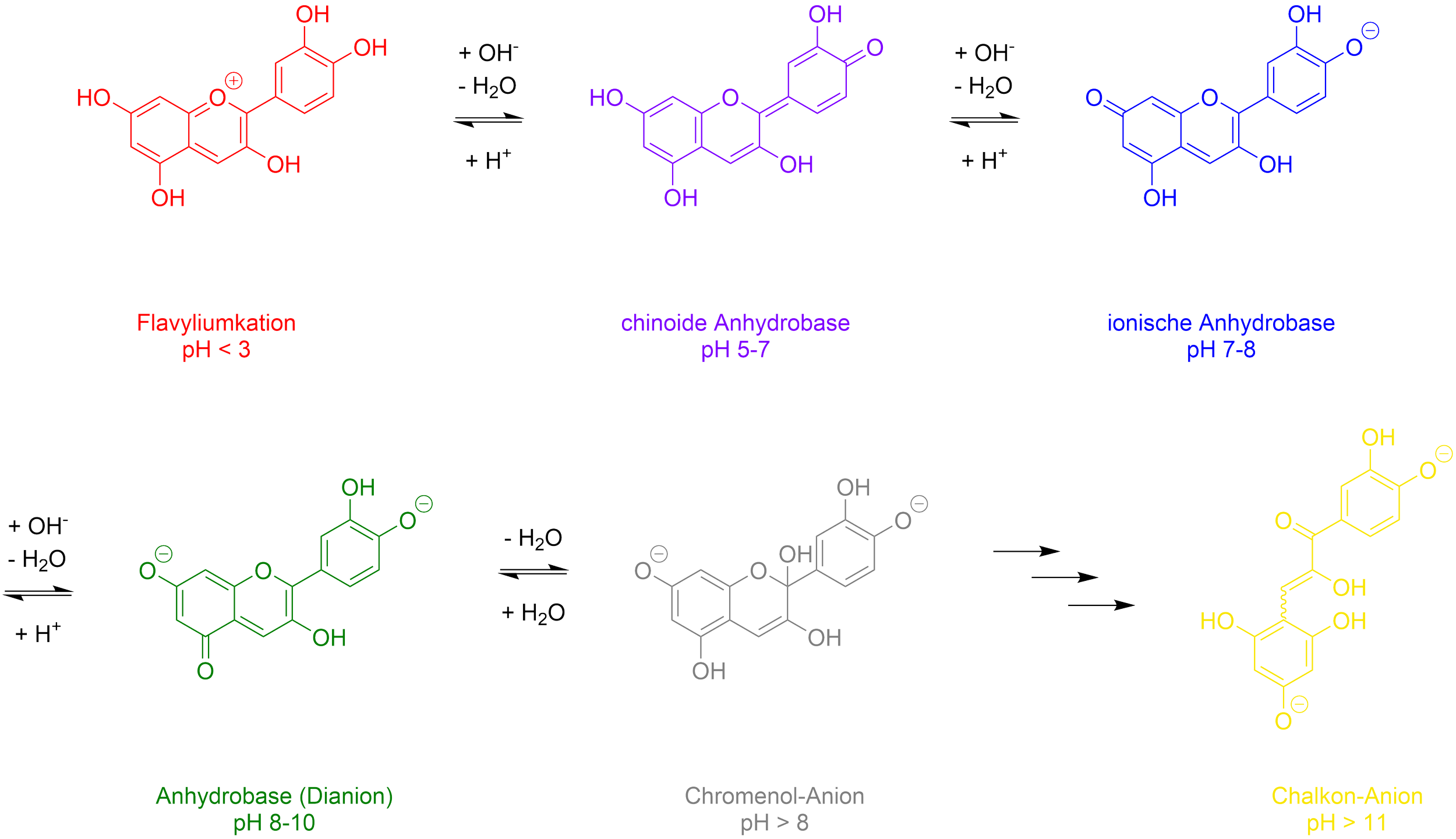
Blaukraut-Indikator
Ein pH-Indikator ist ein Farbstoff, der auf saure oder basische Lösungen mit einer Farbänderung reagiert. Ein bekanntes Beispiel aus dem Haushalt ist Blaukraut bzw. Blaukrautsaft. Dieser wechselt in Anwesenheit von Säuren seine Farbe nach Rot, in Anwesenheit von Laugen nach Blau bis Grün - das ist übrigens auch der Grund für den Namensunterschied: Blau- und Rotkraut wachsen auf Böden mit unterschiedlichem pH-Wert.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Ein pH-Indikator ist ein Farbstoff, der auf saure oder basische Lösungen mit einer Farbänderung reagiert. Ein bekanntes Beispiel aus dem Haushalt ist Blaukraut bzw. Blaukrautsaft. Dieser wechselt in Anwesenheit von Säuren seine Farbe nach Rot, erscheint im Neutralen Blau und in Anwesenheit von Laugen verfärbt er sich Grün bis Gelb. Somit erklärt sich auch der Unterschied zwischen Rotkraut und Blaukraut - es handelt sich hierbei um die selbe Pflanze, jedoch führt der pH-Wert des Bodens auf welchem sie wächst zu einer unterschiedlichen Farbe.
Schwierigkeitsgrad
Schülerversuch - einfach
Geräte
Blaukraut, Magnetrührer, Rührfisch, 400ml Becherglas, 5x 250ml Becherglas, Messer
Chemikalien
30% Salzsäure
Zitronensäure
Natriumhydrogencarbonat
Natriumhydroxid
Durchführung
Ein Teil des Blaukrauts wird in kleine Stücke geschnitten, in das Becherglas gegeben und auf dem Magnetrührer mit dest. Wasser ausgekocht, bis im Wasser eine violette Färbung auftritt.
Nach dem Dekantieren kann der Extrakt nun dazu verwendet werden, pH-Werte von anderen Flüssigkeiten zu untersuchen.
Dazu werden in die 5x 250ml Bechergläser jeweils die gleiche Menge an Extrakt eingefüllt. Dann werden nacheinander verdünnte Lösungen von Salzsäure, Zitronensäure, Natron sowie Natriumhydroxid hinzugegeben.
Entsorgung
Im Abguss.
Erklärung
Bei pH-Werten < 3 liegt das im Blaukraut vorkommende Anthocyan Cyanidin als rotes Flavyliumkation vor. Zwischen pH-Werten von 5 und 7 liegt der Farbstoff als chinoide Anhydrobase vor und erscheint violett. Im leicht alkalischen Mileu kommt es zu einer Delokalisierung der π-Elektronen über die drei Sechsringe und die Sauerstoffatome der Phenolat-Gruppe, was zu einer blauen Färbung führt. Bei pH-Werten ab 8 liegt Cyanidin als grünes Dianion vor, welches mit einem farblosen Chromenol-Anion konkurriert. Im stark alkalischen Mileu kommt es zur hydrolytischen Öffnung des Pyranringes und das Molekül wird zu einem gelben Chalkon-Anion umgewandelt.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Wasserstoffexplosion
Wasserstoff, das erste Element im Periodensystem, ist ca. 14 Mal leichter als Luft, bildet jedoch mit dieser explosionsfähige Gemische.
Auch wenn reine Wasserstoffballone eher verbrennen und nicht wie Gemische mit Luftsauerstoff explodieren oder gar analog zum Chlorknallgallgas schon bei Lichteinstrahlung detonieren, ist dieses Experiment doch sehr eindrucksvoll.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Wasserstoff, das erste Element im Periodensystem und ist ca. 14-mal leichter als Luft. In Verbindung mit letzterer bildet Wasserstoff sogar explosionsfähige Gemische.
Auch wenn reine Wasserstoffballone eher verbrennen und nicht wie Gemische mit Luftsauerstoff explodieren oder gar analog zum Chlorknallgas schon bei Lichteinstrahlung detonieren, ist dieses Experiment doch sehr eindrucksvoll.
Schwierigkeitsgrad
Demonstrationsexperiment - einfach
Geräte
Stativ, Doppelmuffe, Klemme, Luftballon, Fernzünder/Stab mit Kerze
Chemikalien
Wasserstoff
Hinweise
Bei Zündung unbedingt größeren Abstand halten und Mund öffnen. Nicht im Abzug durchführen.
Durchführung
Ein Luftballon wird mit Wasserstoff gefüllt, verknotet und am oberen Ende eines Stativs befestigt. Nun wird der Ballon aus sicherer Entfernung mittels Fernzündung oder eines Langen Stabs gezündet.
Entsorgung
Im Hausmüll
Erklärung
Der Wasserstoff setzt sich gemeinsam mit dem Sauerstoff aus der Luft in einer stark exothermen Reaktion zu Wasser um.
Foto
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Fettexplosion
Fettbrände sind eine reale Gefahr in jeder Küche. Eigentlich sollte daher jeder Schüler die Möglichkeit bekommen, das richtige Löschen zu üben. Von einem Fettbrand geht in der Regel keine Gefahr aus – außer, wenn falsch reagiert wird! Im Ernstfall verhindert Adrenalin rationales Denken, die richtige Reaktion müsste also automatisiert werden. Leider besteht zu dieser Brandschutzübung meistens nicht genug Zeit - eine Demonstration muss hier wohl leider genügen.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Fettbrände sind eine reale Gefahr in jeder Küche. Eigentlich sollte daher jeder Schüler die Möglichkeit bekommen, das richtige Löschen zu üben. Von einem Fettbrand geht in der Regel keine Gefahr aus – außer, wenn falsch reagiert wird! Im Ernstfall verhindert Adrenalin rationales Denken, die richtige Reaktion müsste also automatisiert werden. Leider besteht zu dieser Brandschutzübung meistens nicht genug Zeit - eine Demonstration muss hier wohl leider genügen.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
Dreifuß, Tondreieck, Bunsenbrenner, Metallschälchen, Spritzflasche, Löschdecke, Speiseöl, Feuerzeug
Hinweise
CO2-Feuerlöscher und Löschdecke bereithalten.
Durchführung
Ein kleines Schälchen aus Metall (Glas oder Keramik darf wegen der Bruchgefahr nicht verwendet werden) wird mit < 10 mL (!) Öl befüllt und auf dem Dreifuß mit dem Brenner erhitzt. Das Öl beginnt weiß zu rauchen – diese Dämpfe werden mit dem Feuerzeug entzündet. Der Brenner wird entfernt und aus einigen Metern Abstand mit einer Spritzflasche, bis der Brand gelöscht ist, Wasser in das Feuer gespritzt.
Anmerkung
Manchmal geht der Brand nicht aus, es muss im Vorhinein für eine Möglichkeit gesorgt werden, in diesem Fall das Feuer richtig löschen zu können (z.B. durch eine Löschdecke).
Entsorgung
Kleine Reste Öl werden mit etwas Küchenrolle entfernt und diese im Restmüll entsorgt.
Erklärung
Das Öl heizt sich beim Verbrennen über 100°C – also dem Siedepunkt von Wasser – auf. Gelangt Wasser in das Feuer, verdampft es schlagartig und vergrößert sein Volumen um das Achtfache. Dabei wird viel Öl in die Luft geschleudert, dadurch kommt es mit mehr Sauerstoff in Kontakt, welcher die Verbrennung fördert.
Fotos
Video
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Natrium in Wasser
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann man dieses Verhalten der Alkalimetalle mit Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstrieren.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Alkalimetalle bilden mit Wasser Alkalilaugen unter Wasserstofffreisetzung. Die Reaktivität nimmt dabei von Lithium bis Cäsium zu. Während sich Lithium bei Kontakt mit Wasser nicht entzündet, brennt Kalium sofort und Cäsium explodiert sogar. Richtig durchgeführt kann mit diesem Experiment unserer Reihe Alkalimetalle in Wasser das Verhalten von Natrium relativ ungefährlich – aber trotzdem eindrucksvoll – demonstriert werden.
Schwierigkeitsgrad
Demonstrationsexperiment - mittel
Geräte
(Kunststoff-) Wanne, Filterpapier, Pinzette, Messer
Chemikalien
Natrium
0,1% Phenolphthalein-Lsg. (ethanolisch)
Durchführung
Die Wanne wird zu dreiviertel Wasser gefüllt und ein Filterpapier in die Mitte der Wanne auf die Wasseroberfläche gelegt. Nun wird das ca. erbsengroße Stück Natrium – welches vorher mit dem Messer entkrustet und mit Küchenrolle von der Schutzflüssigkeit befreit wurde - vorsichtig auf das Filterpapier gelegt. Nach einer kurzen Induktionsperiode brennt das Natrium ab und explodiert am Ende.
Das Wasser wird nach der Reaktion mit ein paar Tropfen Phenolphthalein-Lösung versetzt – ein Farbumschlag ist zu beobachten.
Anmerkung
Der Versuch muss unbedingt abseits von brennbaren Gegenständen durchgeführt werden!
Entsorgung
Die Natronlauge wird neutralisiert und kann im Abguss entsorgt werden.
Alle Geräte und Papiere werden mit Wasser behandelt, um eventuell kleine anhaftende Natriumstückchen zu entfernen.
Größere Mengen Natrium werden zuerst mit Isopropanol und dann vorsichtig mit Wasser versetzt. Die Lösung kommt neutral in den Ausguss.
Erklärung
Wenn Alkalimetalle wie Natrium mit Wasser in Kontakt kommen, läuft eine heftige exotherme Reaktion unter Wasserstofffreisetzung ab.
Durch das Filterpapier wird das Natrium am gleichen Ort fixiert. Der entstehende Wasserstoff verdünnt sich daher nicht, erreicht die untere Explosionsgrenze und entzündet sich.
Das entstandene Natriumhydroxid löst sich im Wasser und bildet so eine schwache Natronlauge, darum färbt sich Phenolphthalein violett.
Fotos
Video
Literatur
Gefährdungsbeurteilung (Gestis-Stoffdatenbank und Carl Roth)
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.
Papierchromatografie von Filzstiftfarbe
Die Chromatographie (v. chroma griechisch = Farbe & graphein griechisch = schreiben) ist ein genaues und einfaches chemisches Untersuchungsverfahren. Mit ihr lassen sich Reinstoffe (nur aus einem Stoff bestehend) oder Stoffgemische (aus mehreren Stoffen bestehend) auf Verunreinigungen untersuchen. Weiter kann man präparativ Stoffe voneinander trennen.
Unter Jüngeren sind Filzstifte sehr beliebte Malstifte. Mit dem hier angewandten Versuch einer Papierchromatographie kann sehr eindrucksvoll gezeigt werden, dass beispielsweise Schwarz nicht zu den Grundfarben der Farbenmischung gehört und leicht in seine Bestandteile (Mischfarben) aufgetrennt werden kann.
Allgemeine Hinweise zum Experimentieren und Disclaimer beachten!
Einleitung
Die Chromatographie (v. chroma griechisch = Farbe & graphein griechisch = schreiben) ist ein genaues und einfaches chemisches Untersuchungsverfahren. Mit ihr lassen sich Reinstoffe (nur aus einem Stoff bestehend) oder Stoffgemische (aus mehreren Stoffen bestehend) auf Verunreinigungen untersuchen. Weiter kann man präparativ Stoffe voneinander trennen.
Unter Jüngeren sind Filzstifte sehr beliebte Malstifte. Mit dem hier angewandten Versuch einer Papierchromatographie kann sehr eindrucksvoll gezeigt werden, dass beispielsweise Schwarz nicht zu den Grundfarben der Farbenmischung gehört und leicht in seine Bestandteile (Mischfarben) aufgetrennt werden kann.
Schwierigkeitsgrad
Experiment für zu Hause - einfach
Geräte
Filterpapier (weißes Kaffeefilterpapier/Löschpapier), Glasstab, Becherglas mit Wasser (Gefäß), Bunte (wasserlösliche!) Filzstifte (am besten funktionieren: Braun & Schwarz), Bleistift, Geodreieck
Durchführung
Aus dem Filterpapier wird ein länglicher Streifen ausgeschnitten, der in das Glas passt. Dann wird mit Hilfe des Geodreiecks und dem Bleistift eine gerade Linie ca. 1 cm über dem unteren Ende gezogen.
Mit jedem Filzstift, der analysiert werden soll, wird ein Punkt auf diese Linie gemacht – wobei mindestens 1 cm zum Rand sowie zu den anderen Punkten einzuhalten sind.
Das Filterpapier wird am oberen Ende umgeknickt und über den Glasstab gelegt. Das Becherglas wird so weit mit Wasser gefüllt, dass das Papier gerade noch ins Wasser eintaucht.
Das Papier wird ins Wasser gehängt. Es lässt sich beobachten, wie das Wasser am Filterpapier hochsteigt und auch über die Farbpunkte zieht. Das Filterpapier wird erst wieder aus dem Glas gezogen, wenn die „Laufmittelfont“ (Linie des steigenden Wassers) knapp unter dem oberen Ende des Filterpapiers ist.
Anmerkung
Die bunten Tupfer trennen sich in verschiedene bunte Farben auf. Je nach Fabrikat des Filzstifts entsteht ein unterschiedliches Farbmuster.
Entsorgung
Filterpapier im Hausmüll, Wasser im Abfluss
Erklärung
In der Chromatographie werden unterschiedliche Substanzen in der so genannten mobilen Phase (=Laufmittel) auf einer stationären Phase (= Filterpapier oä.) befördert. Aufgrund der Wechselwirkungen zwischen der Probe, der stationären Phase und der mobilen Phase werden einzelne Substanzen unterschiedlich schnell weitertransportiert und somit voneinander getrennt.
Die Farben in den meisten Filzstiften, insbesondere der Dunklen, werden aus unterschiedlichen Farben zusammengemischt. Die verschiedenen Farbanteile lösen sich zwar alle im Wasser, sie werden aber vom Filterpapier unterschiedlich stark „festgehalten“. Wenn das Wasser das Papier „hinaufkriecht“, benetzt es auch die Farbpunkte.
Das Ganze lässt sich mit einem reißenden Fluss (=Lösungsmittelfront) vergleichen. Dieser kann einiges an Treibgut (=Farbpartikel) mit sich führen. Die Geschwindigkeit, mit der das Treibgut weiterbewegt wird, hängt aber von der Art des Treibguts (Sandkörner werden schneller als Kieselsteine transportiert), von der Beschaffenheit des Flussbetts (raue Oberflächen erhöhen die Reibung des Treibguts und verringern somit die Geschwindigkeit des Abtransports) sowie von der Strömungsgeschwindigkeit ab.
Die Chromatographie wird z.B. in Forschungslaboren genutzt. Denn wenn ein neuer Stoff produziert wird, entstehen bei der chemischen Reaktion noch andere Substanzen. Chromatographische Methoden können dabei helfen, den gewünschten Stoff von den ungewünschten „Nebenprodukten“ abzutrennen.
Foto
Video
Werbung
Diese Anzeige wird von unseren Werbepartnern geschaltet und hilft uns dabei, die Nutzung unserer Website für Sie weiterhin kostenlos zu halten. Durch das Anzeigen dieser Werbung unterstützen Sie direkt unsere Inhalte und ermöglichen es uns, die Kosten für den Betrieb unserer Website zu decken.